概述
此文内容目前处于BETA版本
论文:TCR-Vγδ usage distinguishes protumor from antitumor intestinal γδ T cell subsets. Science. From德国慕尼黑大学医院医学II部、慕尼黑巴伐利亚癌症研究中心的Julia Mayerle团队
正文:full pdf remote. full pdf local;补充材料资源:full sm local. full sm remote
摘要
- γδ T 细胞代表了大部分处于稳态的肠道淋巴细胞,它们构成了浸润结肠直肠癌 (CRC) 的主要淋巴细胞群;然而,它们对 CRC发生或进展的时间贡献仍不清楚。
- 利用人类 CRC 样本和小鼠 CRC 模型,研究者们发现癌前或非肿瘤结肠中的大多数 γδ T 细胞表现出细胞毒性标志物,而肿瘤浸润性 γδ T 细胞则表现出致瘤性特征。这些对比鲜明的 T 细胞谱与人类和小鼠中不同的 T 细胞受体 (TCR)-Vγδ 基因使用有关。
- 纵向交叉遗传学和抗体依赖性策略表明:靶向稳定状态下富集在上皮细胞中的鼠 γδ T 细胞导致肿瘤发展加剧,而靶向在 CRC 期间积累的 γδ 亚群导致肿瘤生长减少。
- 我们的结果揭示了 γδ T 细胞亚群在时间上的促肿瘤和抗肿瘤作用。
概览
- 本文围绕 概述 展开详细讨论
- 包含 17 个主要章节内容
- 文末提供总结与展望
前言
这个文章的解读其实比较早就开始了,只是中途因其它事情,解读的过程断断续续;再加上作者的研究框架我不太熟悉,所以搞了很久才理解清楚本文的核心观点(也有可能还不完全清楚(~ ̄▽ ̄)~,毕竟是CNS级别的论文,还是比较难懂的)。这里我个人有3个建议:
- 阅读本文之前要有一个基本的认识,就是关于研究者如何表征肿瘤发生和肿瘤进展。本文主要有2个自发性肿瘤模型,无论是化学诱导型还是基因型,肿瘤都是经历“无——有——发展”的阶段。研究者通过肿瘤数量来表征肿瘤发生,通过肿瘤大小来表征肿瘤进展。只有把握住这一点,才能理解作者的实验结果如何表征肿瘤发生/发展的不同阶段,也就是所谓的时间特异性。
- 本文在逻辑上一致的实验结果有很多分拆到Supplementary materials里,所以要充分地阅读它们才能比较全面理解研究者的思路。
- 建议阅读正文,这样才能比较好地理解研究者想要表达的观点。
- γδ T细胞和αβ T细胞的功能比较。免疫书上复制过来的(~ ̄▽ ̄)~:
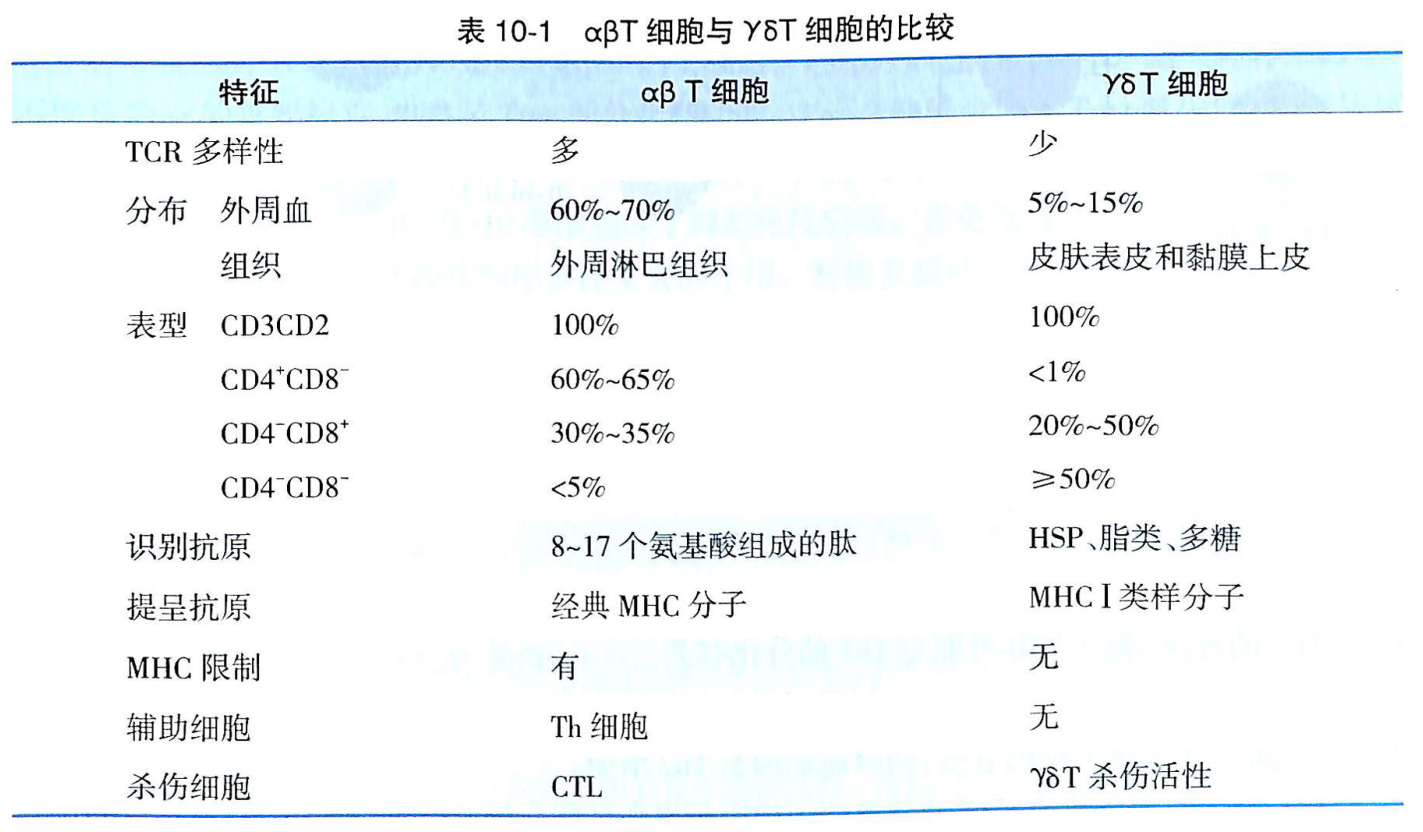
差不多是这样。对于T细胞亚型不太熟悉的,可能还要翻翻免疫学复习一下T细胞的章节。另外,我觉得目前解读仍不太完善,以后有机会再多多补充,先把不太完整的解读发出来吧(主要是鸽太久了心里有点不舒服),大伙也帮忙看看,给点意见。GoGoGo!
结果
人CRC发现组织特异性γδ T 细胞亚群
研究者的思路比较朴素,即通过测量(单细胞测序)临床患者的肿瘤组织、癌旁组织的γδ T 细胞亚群,发现有些γδ T细胞亚群具有促癌性分子特征,有些γδ T细胞亚群却具有抑癌性分子特征。在本文中,抑癌性γδ T细胞亚群主要是IL-17+的。
利用从CRC术后患者的肿瘤组织和癌旁正常肠黏膜组织,通过流式筛选出CD3+SytoxBlue–γδ+细胞:
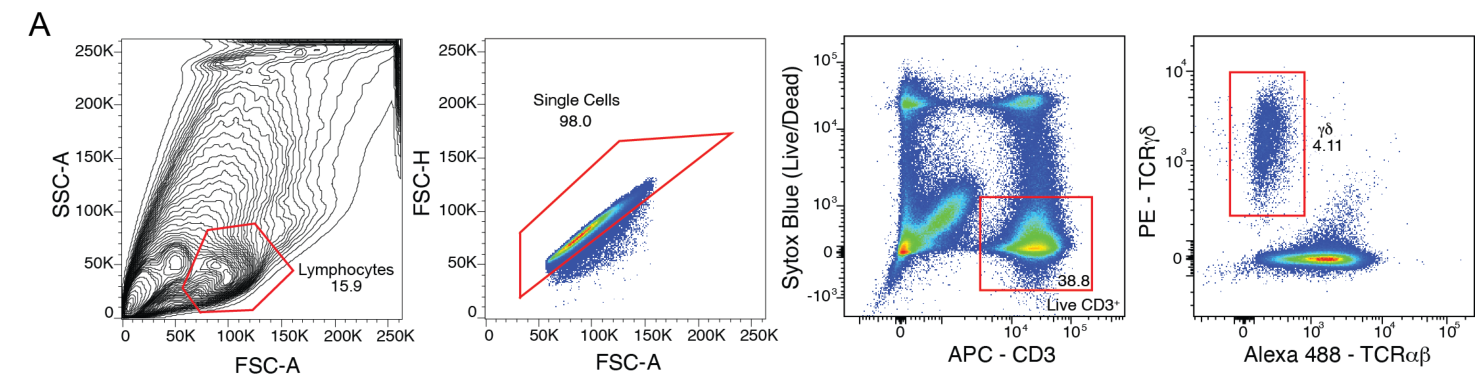
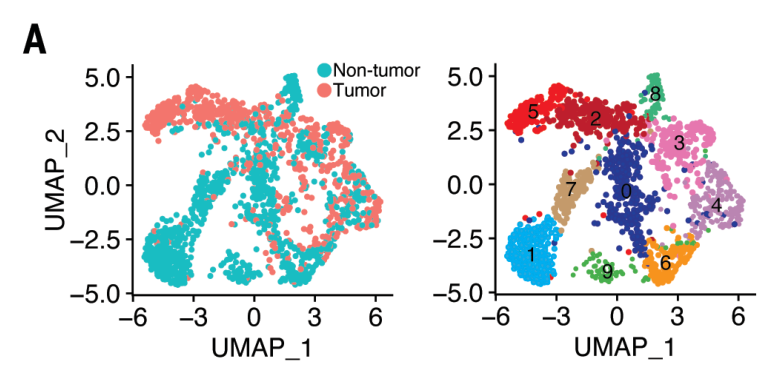
针对癌vs.癌旁的γδ T 细胞进行单细胞测序,发现了10个不同的亚群:
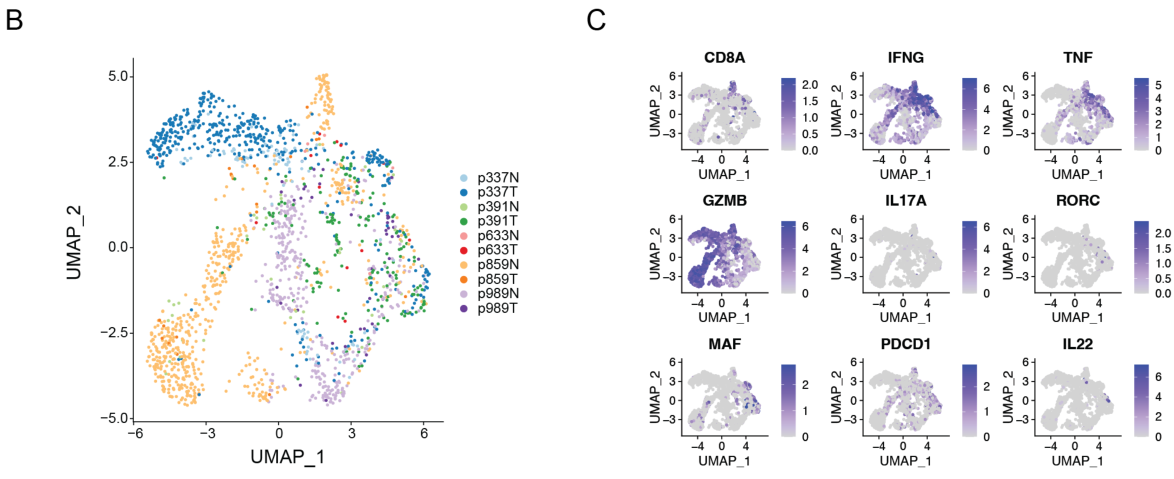
通过GSEA分析,发现肿瘤组织的γδ T 细胞的STAT信号 、脂质代谢合成、细胞因子信号等通路基因表达上调,而IFN信号、TNFα信号等抗肿瘤通路基因表达下调:
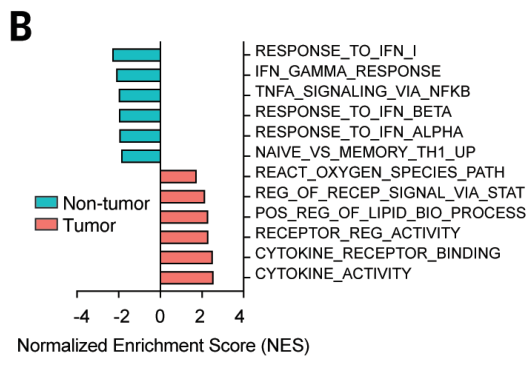
肿瘤组织γδ T 细胞主要属于2/5类(产IL-17),而正常组织主要是0/1类(产IFN-γ)。克隆分析结果表明第5类 γδ T细胞的Vγ4基因(TRGV4)表达较高:
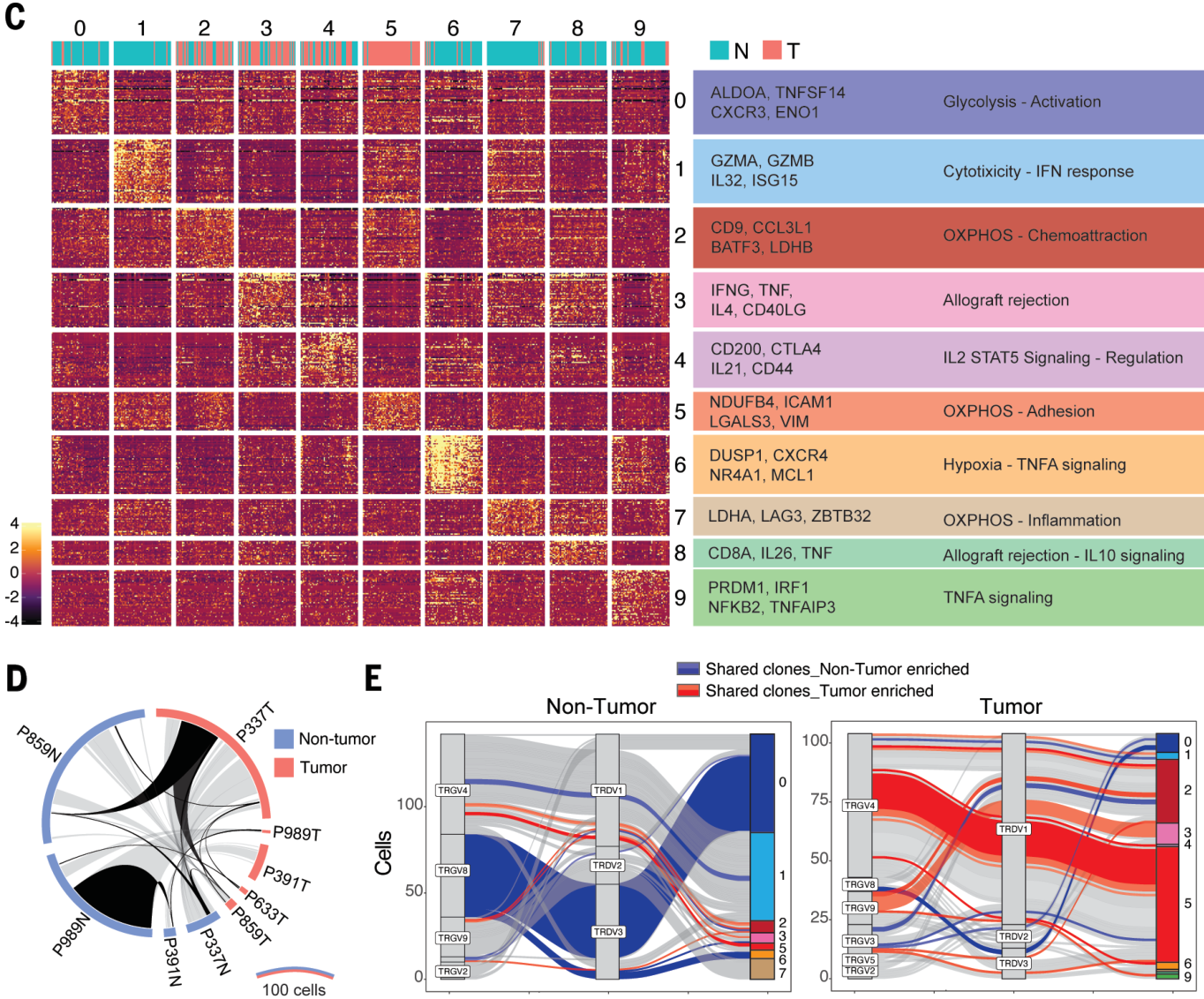
促癌/抑癌性γδ T 细胞亚群共存于CRC中
由于在临床中观察到CRC患者肿瘤组织中促癌/抑癌性γδ T 细胞亚群的共存状态,研究者进一步通过两种不同的自发性CRC小鼠模型以进一步验证和复现临床分子特征的改变,主要是需要观察癌变过程中γδ T 细胞亚群的功能状态变化。研究者们还发现促癌/抑癌性的共存状态在γδ T细胞中比较明显,而CD4+细胞中则不太明显。
在原始小鼠中,结直肠黏膜的γδ T细胞主要表达Vγ1和Vγ7,很少表达Vγ4和Vγ6。为了进一步了解γδ T 细胞亚群与CRC的关系,研究者建立了两种结直肠癌模型——化学诱导型(AOM-DSS性肠炎)和基因型(Cdx2ERApcF/F或称Cdx2Cre-ER x APCfl/fl、iCdx2△APC + tamoxifen诱导):
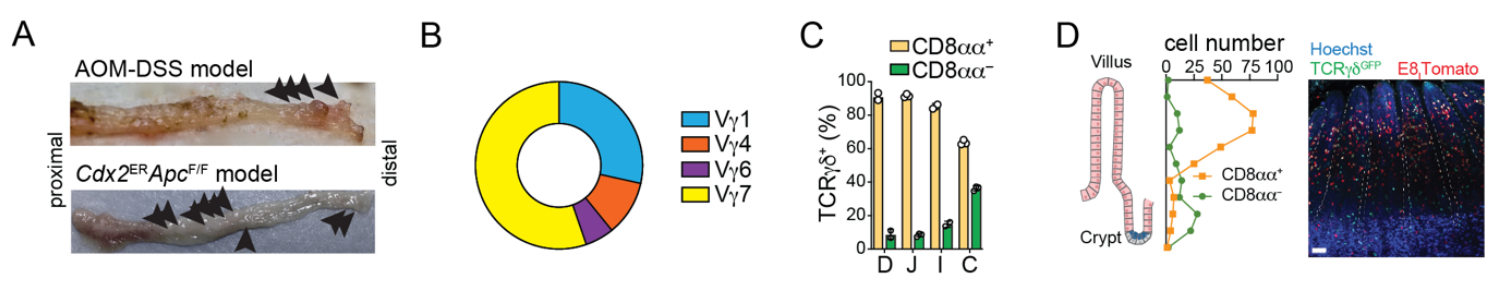
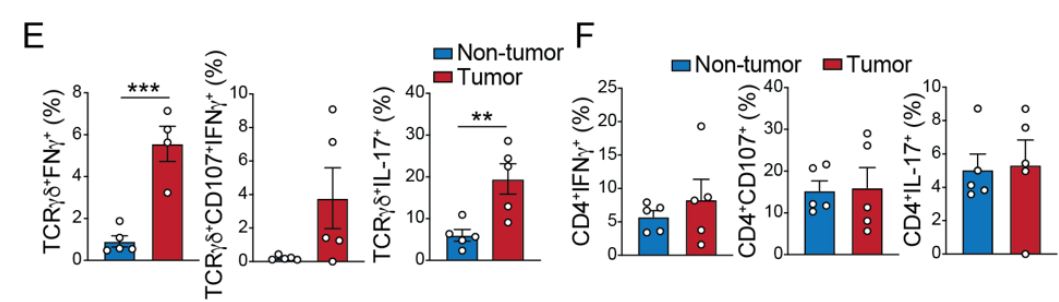
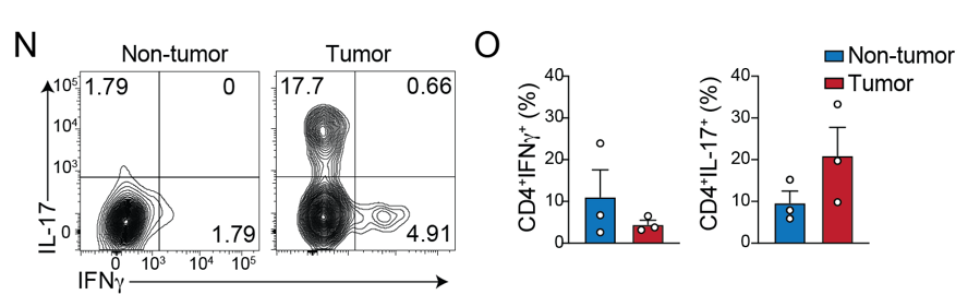
在AOM-DSS结直肠癌模型中,肿瘤组织中γδ T细胞中IFNγ+、CD107+IFNγ+、IL-17+细胞占比均高于正常组织。而另一大亚群——CD4+ T细胞中IFNγ+、CD107+IFNγ+、IL-17+细胞占比则无明显差异,这表明γδ T细胞亚群在CRC中的作用可能比CD4+ T细胞更加重要:
在tamoxifen治疗iCdx2 △APC小鼠的自发CRC模型中,每周检测IELs的CD8或PD-1/IL-17的含量,发现抑癌性的CD8α+的γδ T细胞比例不断下降,而免疫抑制性的PD-1/IL-17阳性γδ T细胞比例却不断上升:
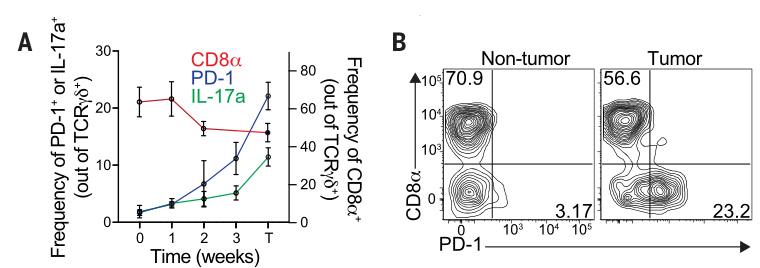
在AOM-DSS结直肠癌模型也有类似的结果:
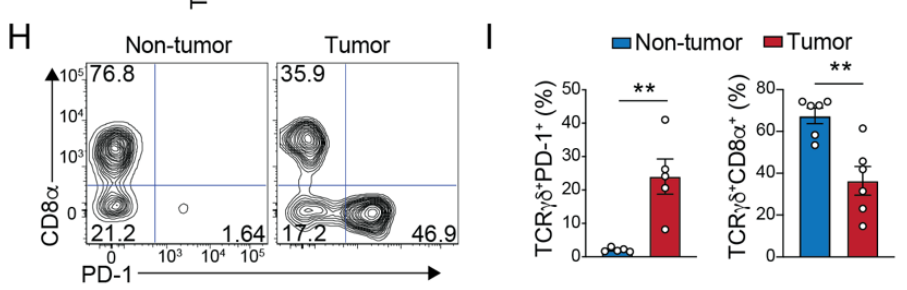
在tamoxifen治疗iCdx2 △APC小鼠的自发CRC模型中,PD-1+肿瘤浸润γδ T细胞的IFN-γ水平较低,而IL-17水平较高,表现出免疫抑制状态:
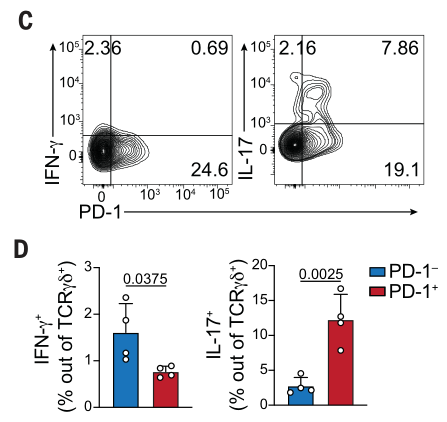
在AOM-DSS模型中的结果也是类似的:
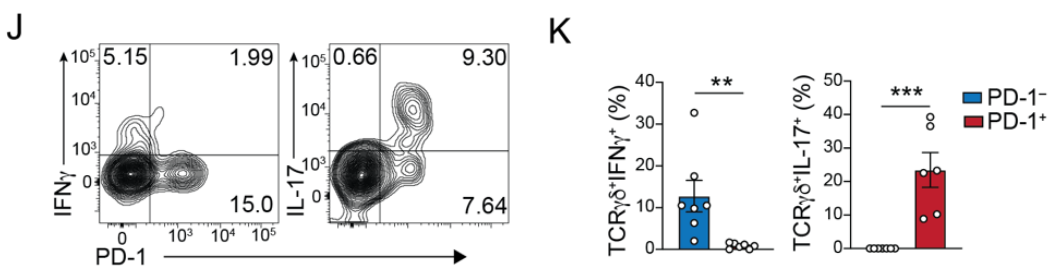
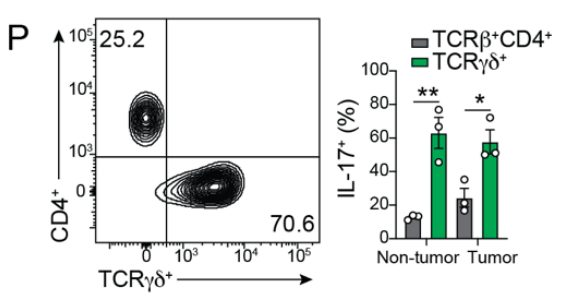
在tamoxifen治疗iCdx2 △APC小鼠的自发CRC模型中,肿瘤组织的γδ T细胞的IL-17、PD-1水平高于正常组织,IFNγ水平也高于正常组织;CD8α的水平则相当;肿瘤组织的CD4+ T细胞的IFNγ水平有所下降、IL-17水平有所上升,但这种差异并不显著。此外,无论是正常组织还是肿瘤组织,γδ T细胞的IL-17水平均远高于TCRβ+CD4+细胞:
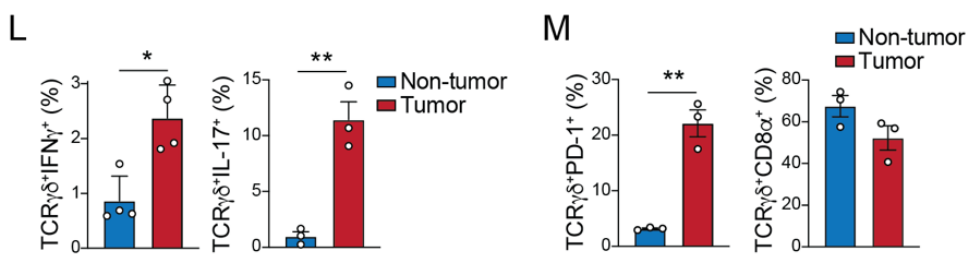
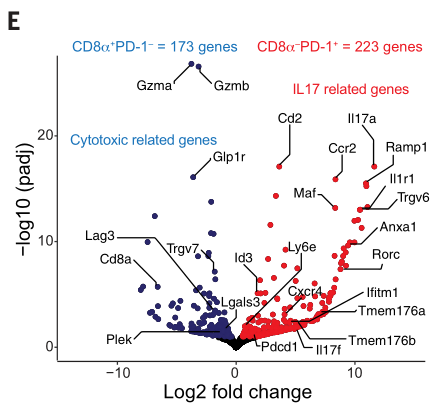
在AOM-DSS模型中,γδ T细胞进一步细分为CD8a+ PD-1−和CD8a− PD-1+ 两个亚群。RNA-Seq的结果表明,CD8a+ PD-1−亚群高表达细胞毒性基因,CD8a− PD-1+ 亚群则高表达 IL-17相关基因,进一步佐证了部分γδ T细胞的处于免疫抑制状态:
在AOM-DSS模型中,肿瘤vs.正常组织的scTCR-seq结果表明TCR分布的显著差异。在肿瘤前病变向肿瘤发展的过程中,Vγ6类TCR比例大幅升高,而Vγ1/7类TCR比例则有所下调:
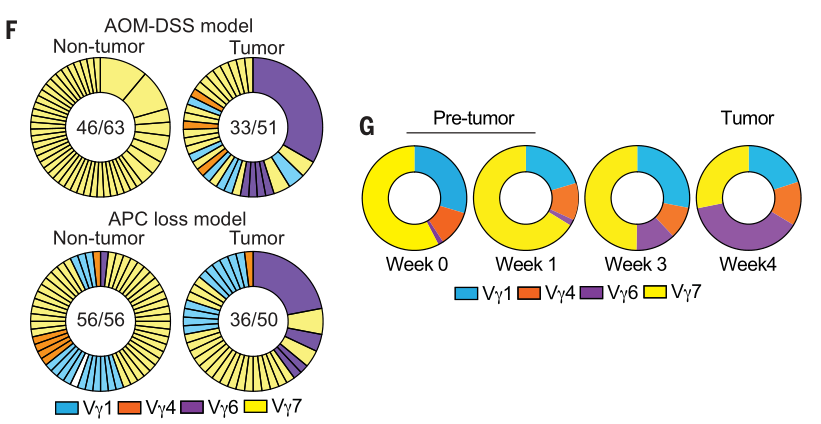
流式的结果也进一步表明:与正常组织相比,肿瘤组织中富含Vγ6 TCR的γδ T细胞,而Vγ7 TCR的γδ T细胞的比例则相对较低:
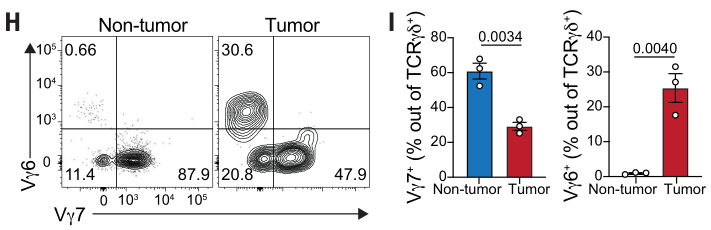
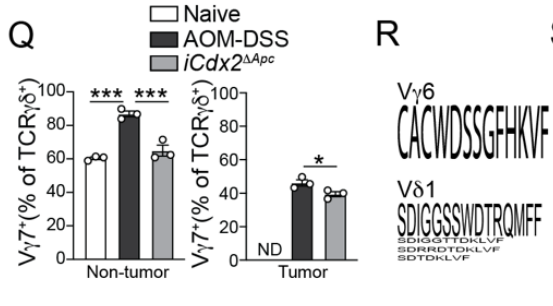
在IL-17/PD-1阳性(免疫抑制性)的肿瘤浸润γδ T细胞中,Vγ6 TCR水平极高;而在IFNγ阳性(免疫活性)的肿瘤浸润γδ T细胞中几乎检测不到Vγ6,这提示Vγ6与γδ T细胞的抑制性功能密切相关:
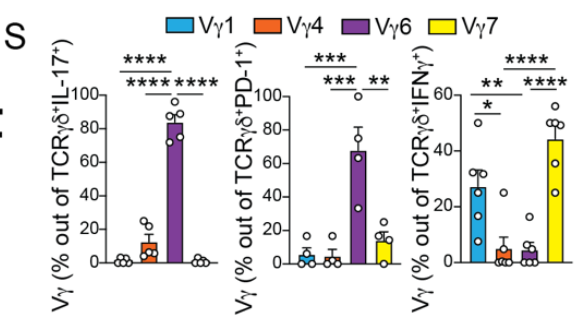
上皮定植Vγ1+和Vγ7+ γδ T细胞的失活/清除导致肿瘤数量增加
Trdc-/-小鼠具有γδ T细胞的功能缺陷,是一个常用的动物模型。研究团队既往研究表明上皮定植的γδ T细胞控制早期侵袭的过程依赖于Glut1(即Slc2a1)。由于Trdc-/-小鼠对DDS比较敏感,研究者还观察了DSS低剂量(1%)对小鼠成瘤的影响。研究者还通过Vγ7基因编辑、anti-Vγ1直接观察γδ T细胞的抗肿瘤效应。作者主要的结论是小鼠肠上皮定植的Vγ1+和Vγ7+ γδ细胞对肿瘤形成的早期控制具有重要作用。
γδ T细胞失活对肿瘤发生、发展的作用
为了评估上皮滞留γδ T细胞是否参与CRC的限制,通过品系杂交构建iTrdcSlc2a1fl/+小鼠(单倍失活)、iTrdc△Slc2a1(二倍失活)小鼠和同窝对照组小鼠 (iTrdcSlc2a1+/+ ) ,通过AOM-DSS喂养构建结直肠癌模型。低剂量DSS对Trdc-/-小鼠基本不成瘤:
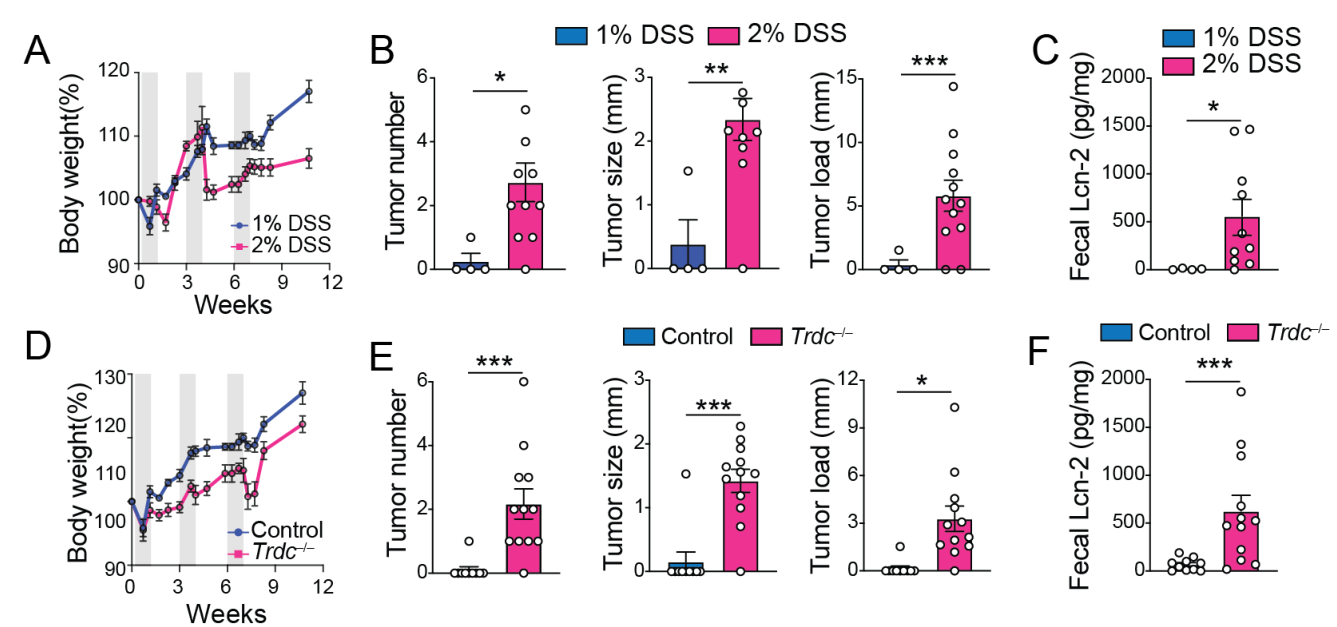
与对照组相比,γδ T细胞存在Slc2a1缺陷的小鼠的体重更轻,且肿瘤数量更多、肿瘤负荷更重。值得注意的是,Slc2a1的单/二倍失活之间的差异并不显著:
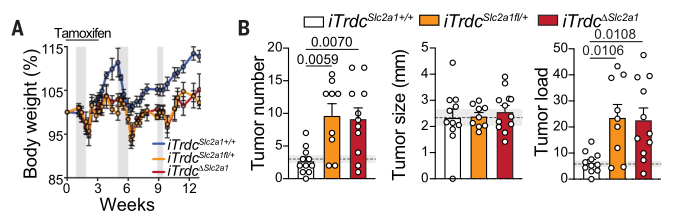
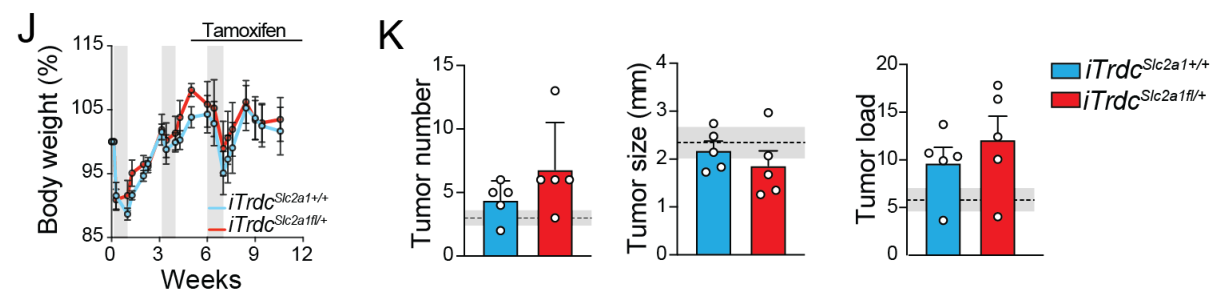
无论γδ T细胞中Slc2a1的功能状态如何,与正常组织相比,肿瘤组织中γδ/αβ T细胞的比例均有所下降;且γδ T细胞的Vγ7水平也有所下降。不过,αβ T细胞的CD8αβ及IFNγ水平在肿瘤和正常组织中的分布并无明显差异(因为基因编辑未干预到αβ细胞且其与肿瘤发展的关系并不密切):
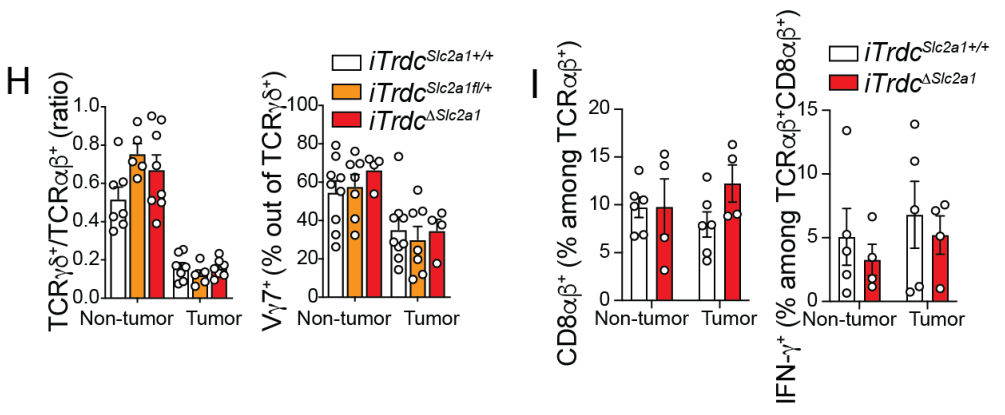
这3组小鼠肿瘤/非肿瘤组织的浸润γδ T 细胞分析表明:与正常组织相比,肿瘤浸润γδ T 细胞的CD8α水平较低,而PD-1、IFN-γ、IL-17表达较高。此外,γδ T 细胞的Slc2a1功能缺陷程度与IFN-γ表达水平呈正相关,与IL-17表达水平呈负相关,这表明γδ T细胞的抗肿瘤功能亚群的发展依赖Slc2a1:
Vγ1+/Vγ7+ γδ T细胞的作用
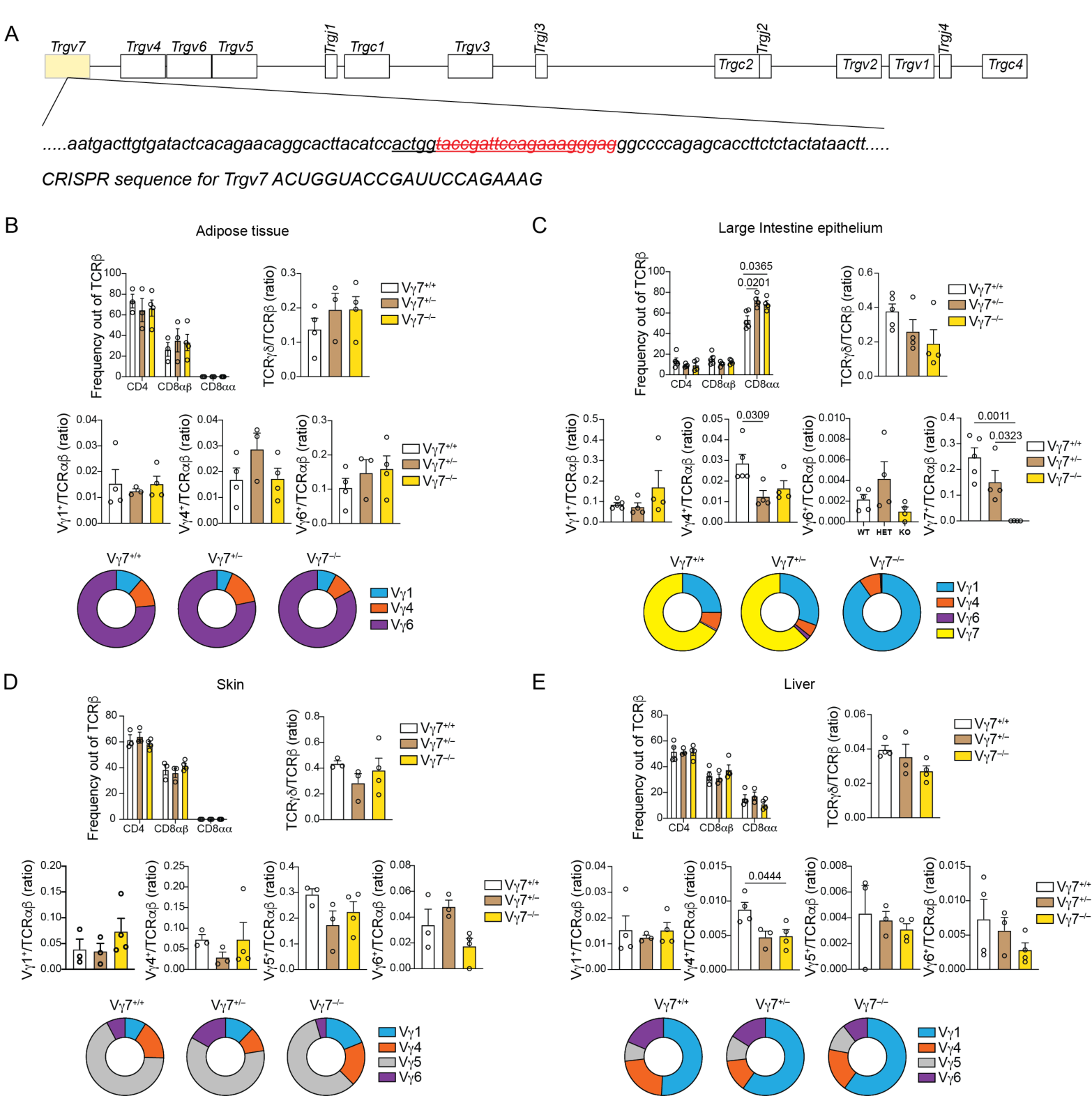
为了直接评估上皮定植γδ T细胞的抗肿瘤作用,构建Vγ7转基因小鼠模型(对照、单倍缺失、二倍缺失)。脂肪组织、大肠上皮、皮肤和肝脏的TCRαβ细胞的Vγ进行检测证明了建模有效性:
为什么脂肪组织没有Vγ7的测量数据?
在Vγ7+/+、Vγ7+/-和Vγ7-/-的小鼠中通过AOM-DSS策略建立CRC模型,发现Vγ7水平对肿瘤数量和肿瘤大小无明显影响,尽管Vγ7-/-小鼠肿瘤中的γδ T细胞比例显著降低。这表明Vγ7对CRC的肿瘤发生和肿瘤进展无显著影响:
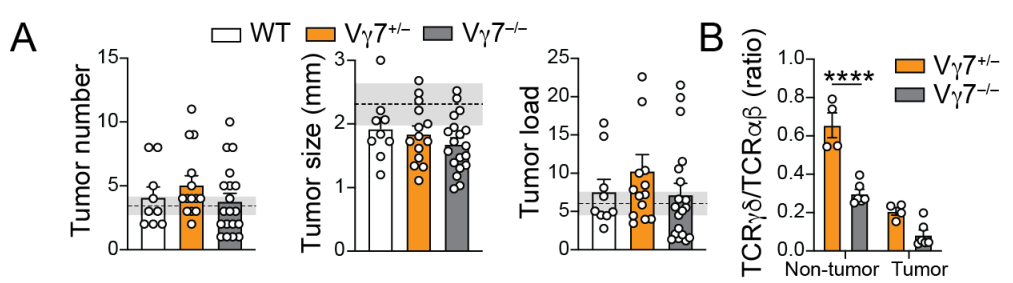
对Vγ7+/+、Vγ7+/-和Vγ7-/-小鼠的肿瘤进行Vγ检测后发现,在正常组织中,Vγ7缺失可导致γδ T细胞的CD8αα、CD4+ αβ T细胞的IL-17的水平下降,但在肿瘤组织中无显著影响。在肿瘤组织中,Vγ7缺失可抑制αβ T细胞的Vγ4/6表达,但在正常组织中无显著影响。(?):
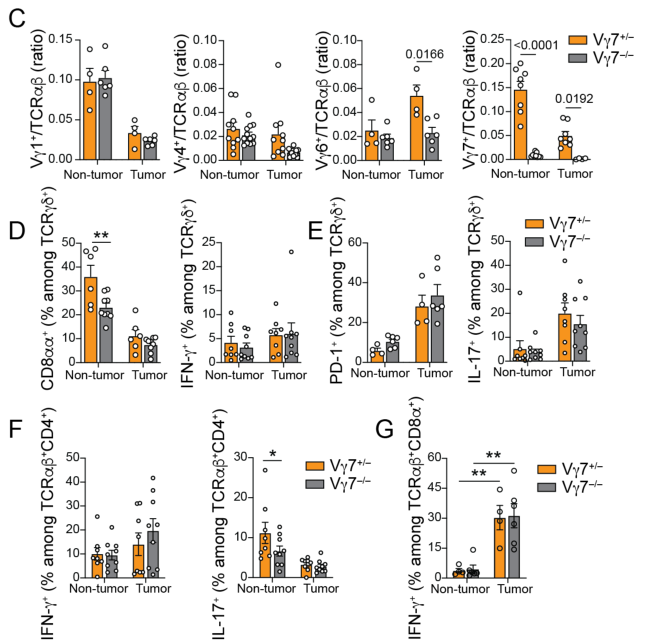
在Vγ7+/+、Vγ7+/-和Vγ7-/-的小鼠中进行anti-Vγ1治疗时,无论是肿瘤或者是正常组织,Vγ7状态对CD4+ αβ T细胞、CD8αβ+ αβ T细胞的IFN-γ或IL-17水平均无明显影响:
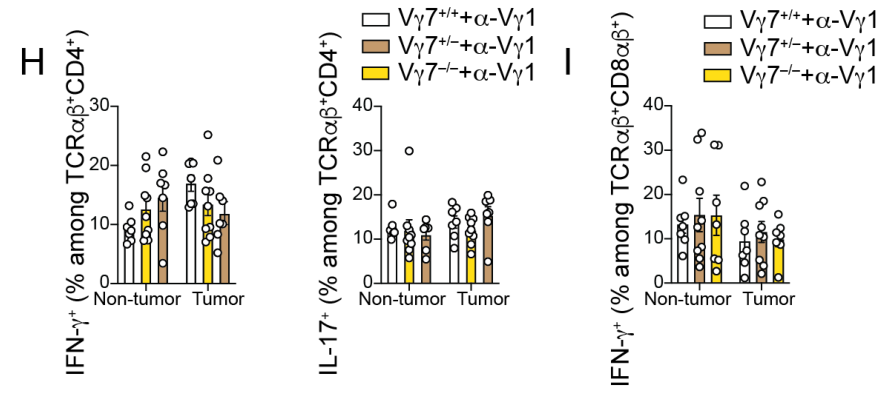
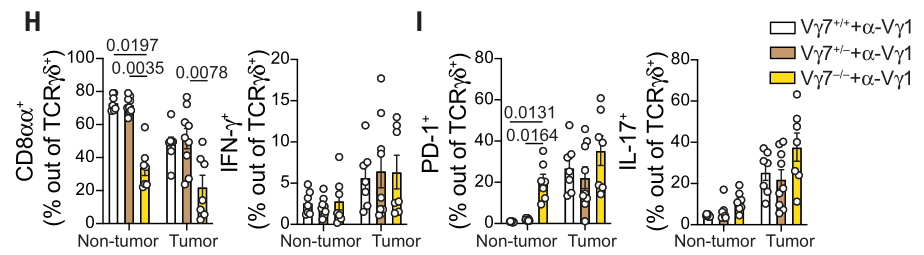
在Vγ7+/+、Vγ7+/-和Vγ7-/-的小鼠中进行anti-Vγ1治疗,发现Vγ7缺失小鼠的肿瘤数目更高,而平均肿瘤大小无明显差异;Vγ7缺失后,肿瘤组织的γδ TCR、Vγ1相对含量有所下降,而Vγ4和Vγ6则无明显影响。结合之前的实验,这表明Vγ1+和Vγ7+ γδ T细胞共同参与对肿瘤发生的抑制作用:
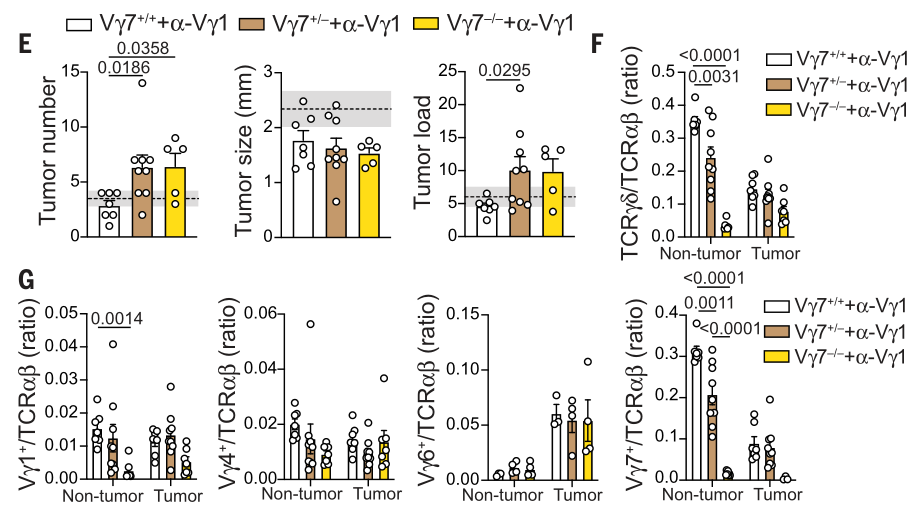
进行anti-Vγ1治疗时,Vγ7+/+或Vγ7+/-小鼠正常组织中γδ T细胞的CD8αα水平高于Vγ7-/-组小鼠,PD-1水平则低于Vγ7-/-组小鼠;而在肿瘤组织中,Vγ7+/+、Vγ7+/-或Vγ7+/-小鼠的抗肿瘤/促肿瘤细胞因子的水平并无明显差异。这在分子水平上表明Vγ1/Vγ7 γδ T细胞主要在肿瘤早期阶段对肿瘤具有限制作用:
IL-17+ γδ T 细胞促进肿瘤生长的过程依赖微生物组和TCR
之前的研究发现了影响肿瘤发生的γδ T细胞亚群(Vγ1+/Vγ7+)。这部分主要是证明影响肿瘤进展的γδ T细胞亚群是Vγ4+/Vγ6+(分泌IL-17)。
IL-17+ γδ T细胞的促肿瘤作用
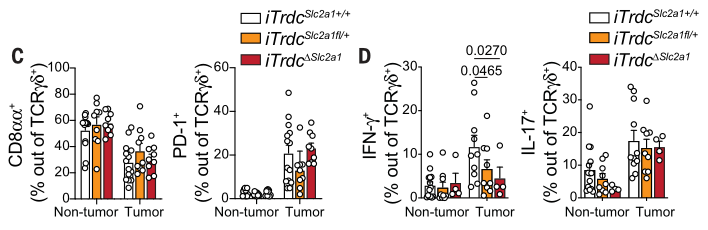
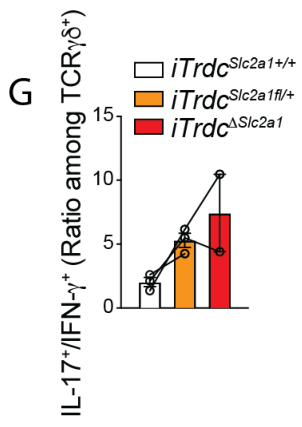
因为Rorγt是T细胞生产IL-17的主要细胞因子,所以通过对Rorγt基因和Trdc基因的基因编辑可以构建研究IL-17+ γδ T功能的小鼠模型——iTrdc△Rorc(双倍体失活)和iTrdcRorc fl/+(单倍体失活)。利用tamoxifen腹腔注射构建自发性肿瘤模型,研究者发现iTrdc△Rorc小鼠肿瘤大小显著小于对照组iTrdcRorc fl/+,这表明IL-17+ γδ T细胞可促进肿瘤进展,但对肿瘤发生无明显影响:
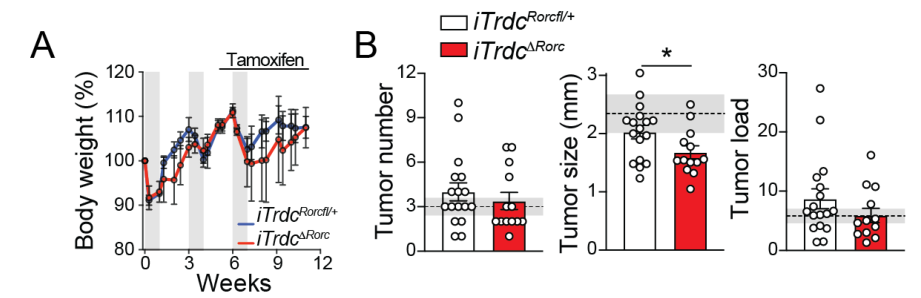
与对照组iTrdcRorc fl/+相比,iTrdc△Rorc小鼠肿瘤中的γδ T细胞的Vγ7比例大幅上调,同时伴有Vγ4/6比例的下调。在肿瘤组织中,iTrdc△Rorc小鼠 γδ T细胞的CD8α水平与对照组相比无明显差异;但PD-1和IL-17水平则大幅降低。在肿瘤组织中,iTrdc△Rorc小鼠 CD4+ αβ T细胞的CD8αβ和IL-17的水平与对照组iTrdcRorc fl/+相比无明显差异:
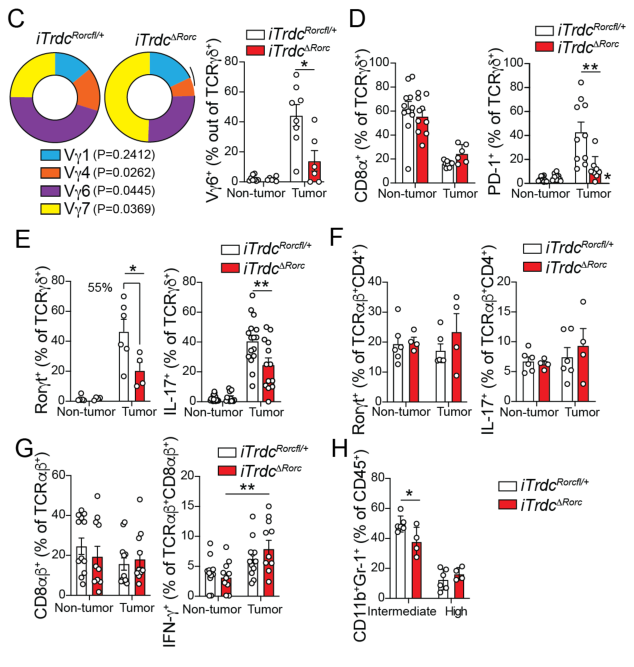
肠道菌群诱导Vγ6+ γδ T细胞的促肿瘤作用
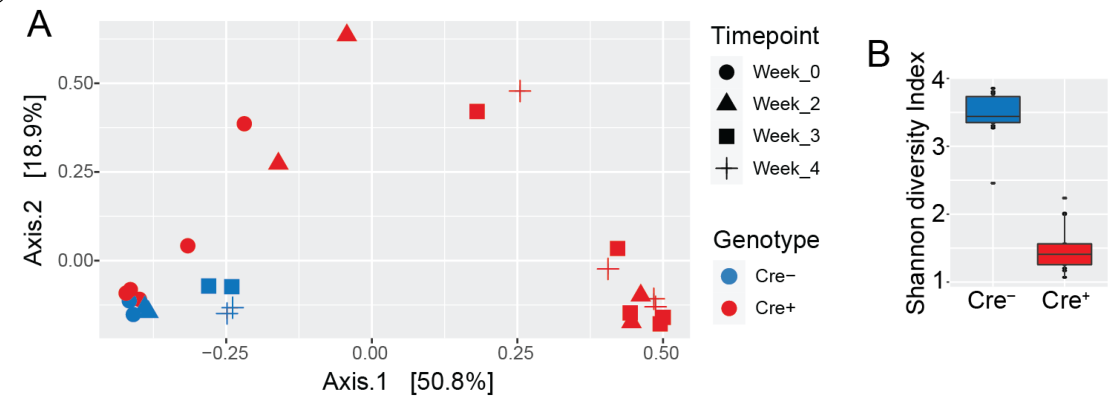
接下来,为了研究肠道菌群对γδ T细胞功能的影响,研究者们使用了APC基因编辑模型(iCdx2△APC小鼠)而不是DSS化学诱导模型(DSS喂养对肠道菌群的影响比较复杂)。利用iCdx2△APC小鼠进行tamoxifen腹腔注射构建自发性CRC模型,研究者对模型小鼠粪便颗粒的16S rRNA测序分析发现,随着时间的推移,iCdx2△APC小鼠和对照组小鼠的肠道菌群分布差异逐渐显著,这表明CRC发展过程中肠道菌群分布在发生显著变化:
在第3-5周,通过水服抗生素复合制剂(ABX)清除iCdx2△APC小鼠的肠道微生物。与对照组相比,喂养ABX的小鼠肿瘤体积有所减小,但肿瘤数目和肿瘤负荷无明显差别,这表明肠道微生物介导的抗肿瘤效应发生在肿瘤发展的较晚期:
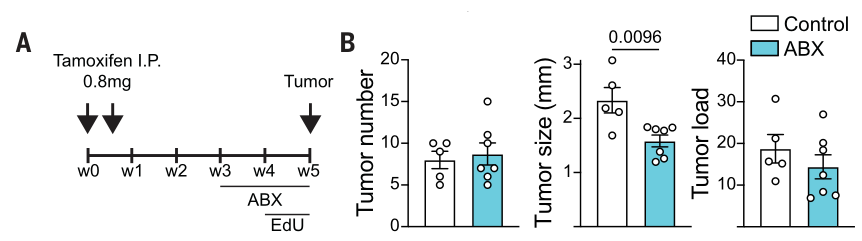
喂养ABX后,iCdx2△APC小鼠的肿瘤浸润TCRαβ+ CD8αβ+ T细胞的IFN-γ水平有所上调:
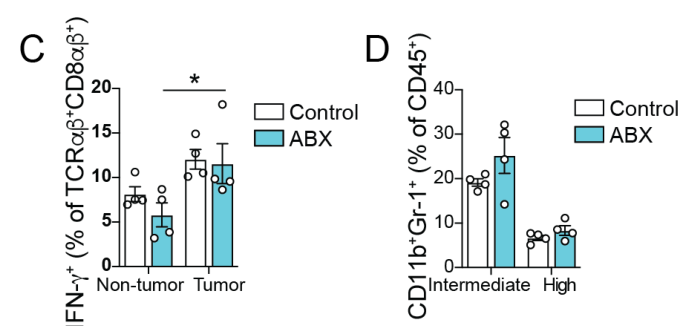
针对iCdx2△APC小鼠γδ T细胞进行流式检测,发现喂养ABX后,无论是正常组织还是肿瘤组织,γδ T细胞的CD8α水平均显著上调,且PD-1和IL-17水平均下调,而此改变主要发生在Vγ6+ γδT细胞中。这表明肠道菌群促进了Vγ6+ γδT细胞的促肿瘤功能态,肠道菌群清除可导致促肿瘤Vγ6+ γδT细胞的促肿瘤功能大幅减弱:
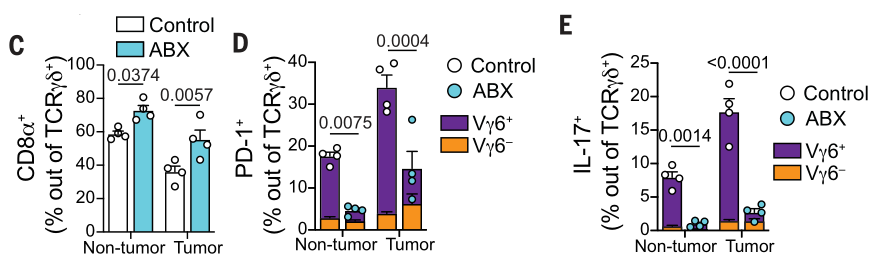
体内EdU+流式的分析表明:肿瘤组织Vγ6+ γδT细胞增殖能力比Vγ6– γδT细胞更强,但喂养ABX后Vγ6+ γδT细胞增殖能力减弱:
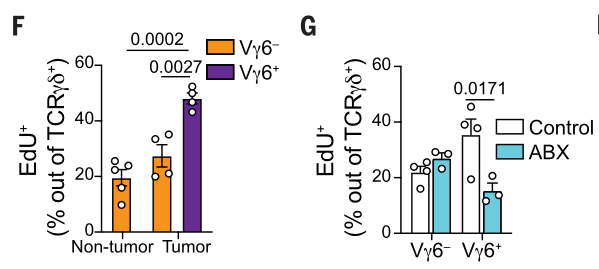
针对TCR类型的研究发现ABX对Vγ4 γδT细胞的浸润水平无显著影响:
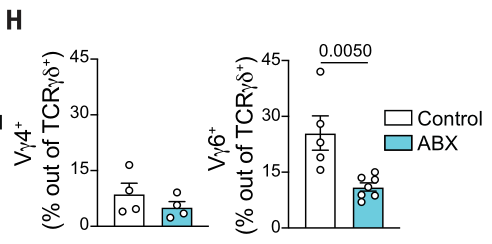
上述实验结果从多个角度表明:肠道菌群可通过调控Vγ6+ γδT细胞功能影响肿瘤生长。
靶向TCRγδ的抗肿瘤潜力
为了评估靶向TCRγδ调控肿瘤生长的潜力,研究者们在实验最后两周的小鼠每周给予两次anti-TCRγδ治疗。研究者们发现,anti-TCRγδ治疗对降低成瘤数量、成瘤体积和肿瘤负荷均有显著效果:
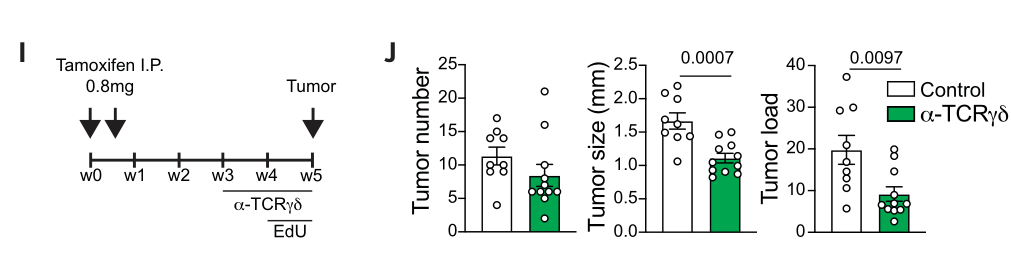
与之对应的,肿瘤浸润γδT细胞的CD8α水平显著上升(尽管伴随INF-γ水平一定程度下降),并且PD-1/IL-17水平均有所下调(特别是IL-17):
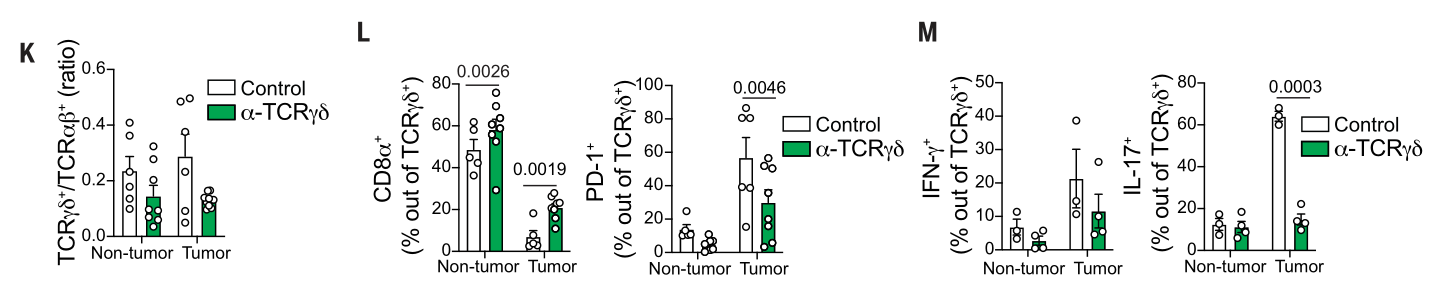
另外,体内EdU+流式的分析表明:anti-TCRγδ治疗明显抑制γδT细胞的增殖,并且不依赖其PD-1水平:
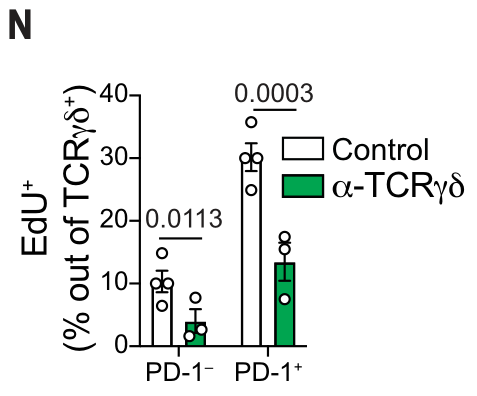
在不同周数观察肿瘤组织中TCRγδ分布,发现肿瘤发展过程中TCRγδ水平不断下调,而anti-TCRγδ治疗后其分布明显上调?
是不是有点矛盾?看细点。
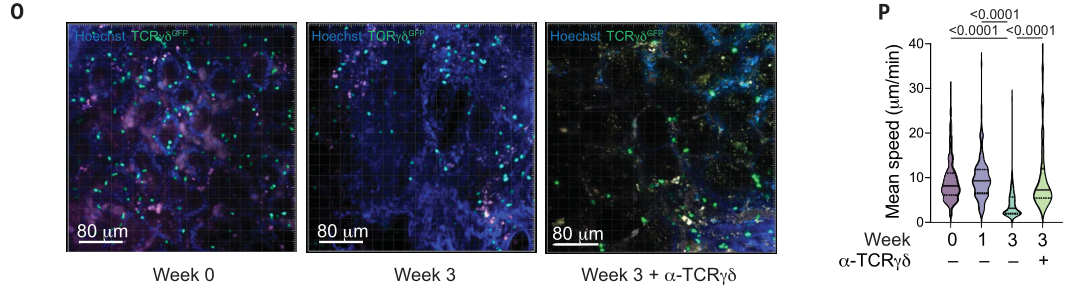
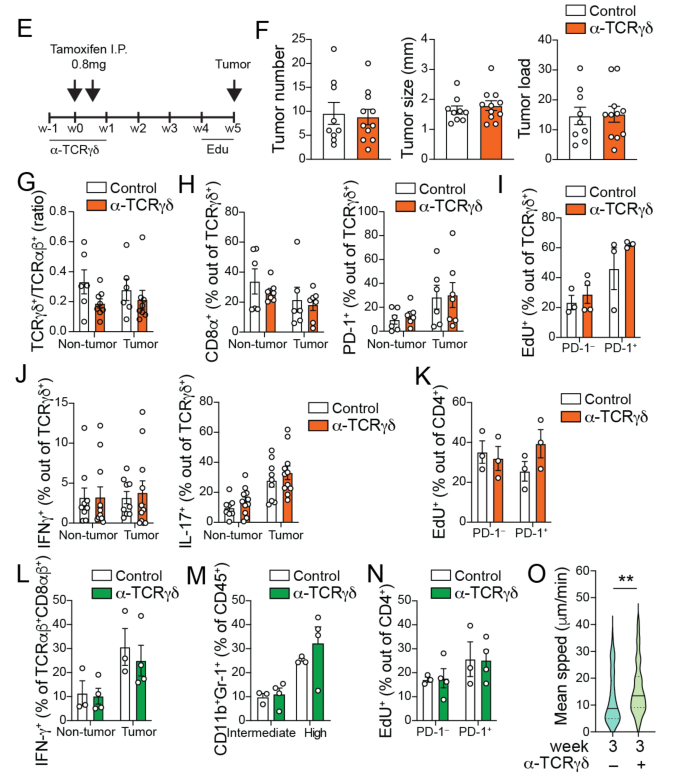
此外,作者还测试了在Tamonxifen注射早期(w-1~w1)的阶段给予anti-TCRγδ治疗,发现肿瘤数量、肿瘤大小、肿瘤负荷均无明显差异,说明anti-TCRγδ对Tamonxifen诱导的肿瘤发生没有显著影响。同时,早期使用anti-TCRγδ治疗对γδ/αβ T细胞比例、γδ T细胞的CD8α、PD-1、EdU、IFN-γ、IL-17表达水平均无明显影响;不管PD-1状态如何,早期使用anti-TCRγδ治疗对对CD4+ T细胞增殖无明显影响:
Vγ6+和Vγ4+ γδ T细胞分泌IL-17+并促进肿瘤生长
之前的研究表明靶向Vγ6+/Vγ4+ γδ T细胞可能具有抑制肿瘤发生的作用。这部分实验证明,只有同时靶向Vγ6和Vγ4才可以发挥抑制肿瘤发生的作用,而仅靶向Vγ6并不能抑制早期肿瘤的形成。
仅靶向Vγ6对肿瘤进展无明显影响
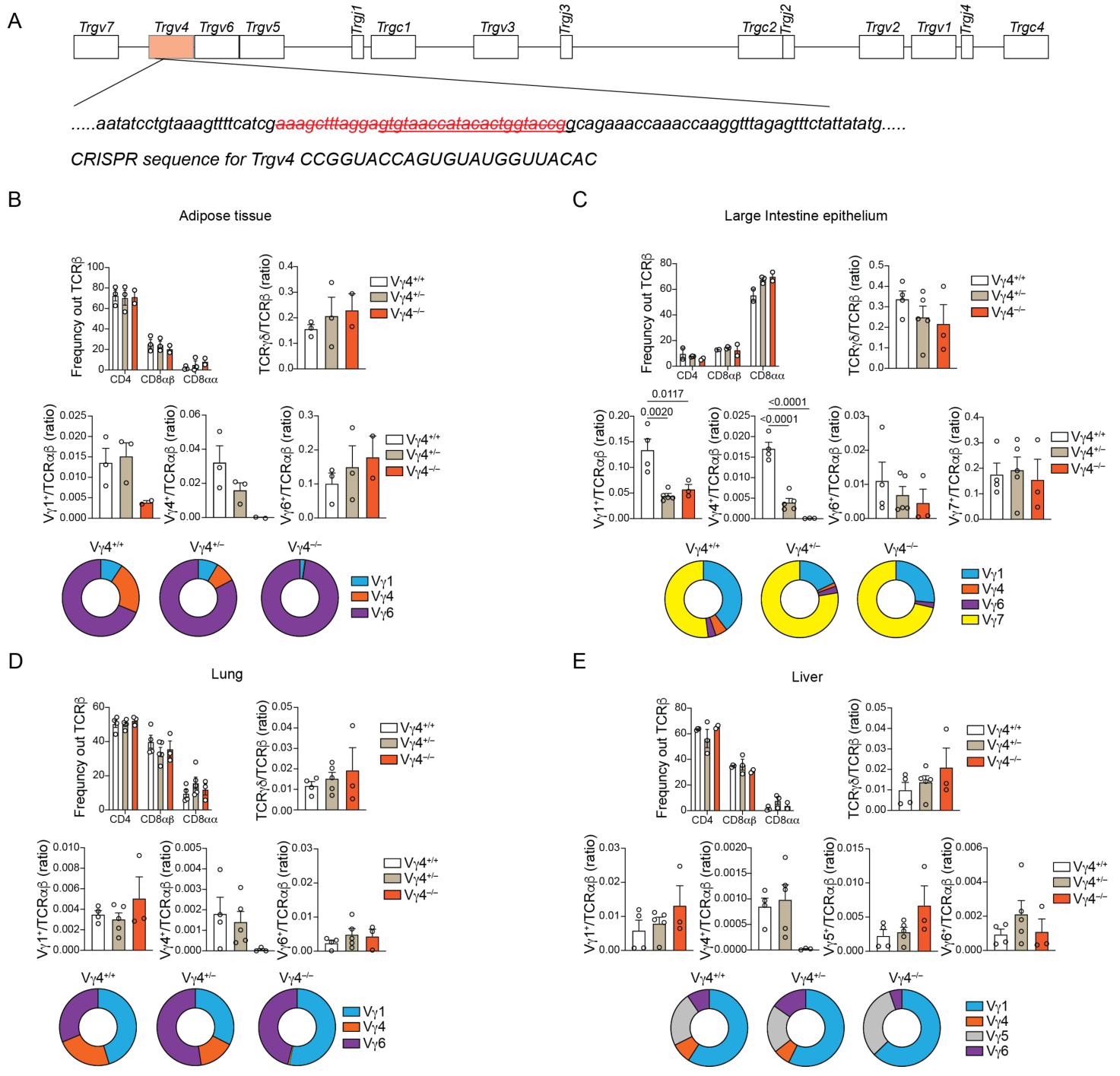
构建Vγ4−/−小鼠模型,并对脂肪、大肠、肺、肝等组织进行Vγ亚型检测以检证模型有效性:
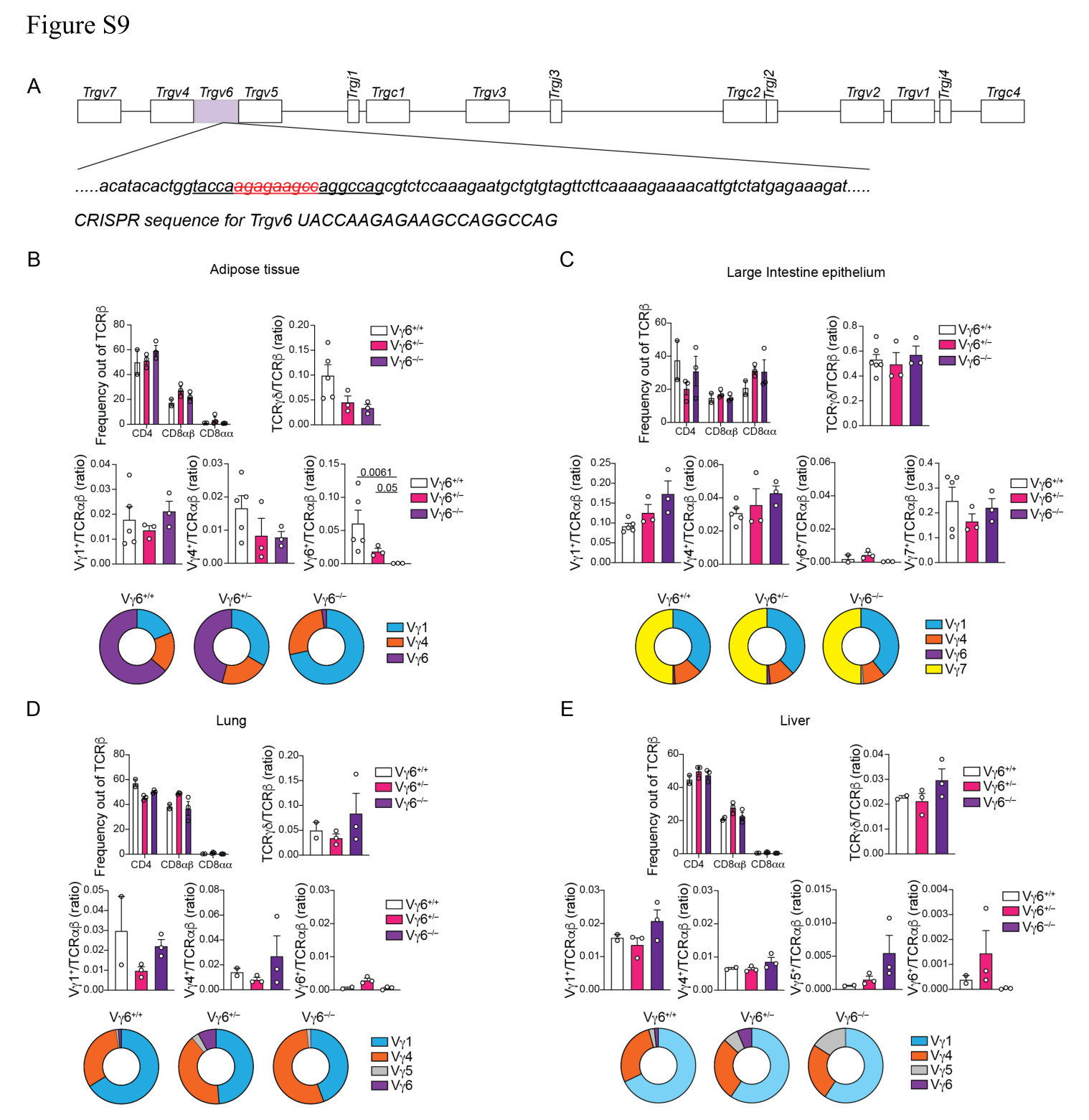
构建Vγ6−/−小鼠模型,并对脂肪、大肠、肺、肝等组织进行Vγ亚型检测以检证模型有效性:
基于成功构建的Vγ6+/-和Vγ6-/-小鼠,利用AOM-DSS建立自发性肿瘤模型。研究者们发现,Vγ6-/-的肿瘤数目和肿瘤负荷略高于Vγ6+/-小鼠:
为什么分组中没有纳入Vγ6+/+小鼠呢?
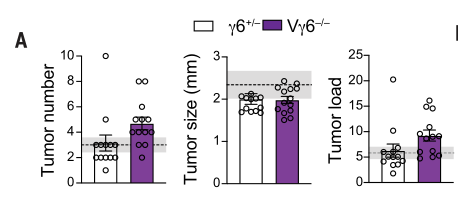
无论在肿瘤还是正常的肠黏膜组织,Vγ6+/-和Vγ6-/-小鼠的浸润γδT细胞比例并无明显差异。不过,与Vγ6+/-小鼠相比,Vγ6-/-小鼠的肿瘤浸润γδTCR的Vγ4水平显著上调。流式的结果表明,Vγ6缺失对肿瘤浸润γδT细胞的CD8α和IFN-γ水平无明显影响,也仅轻微地下调PD-1和IL-17水平:
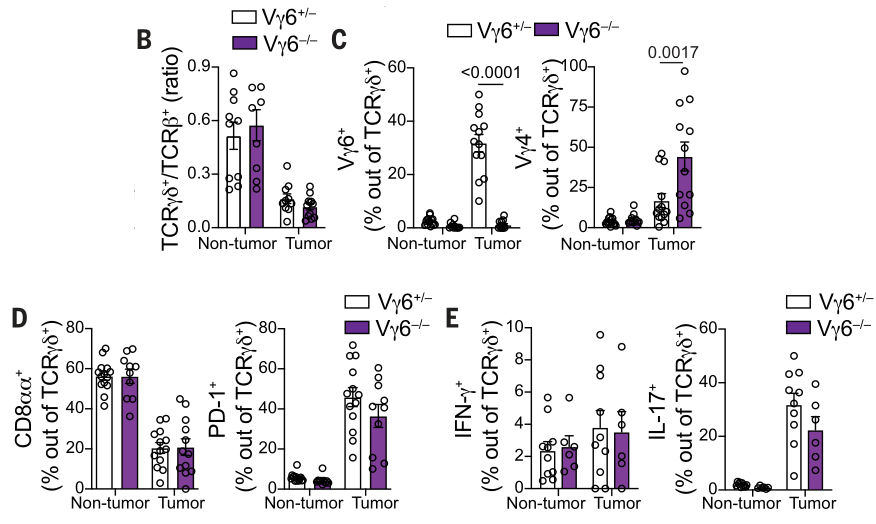
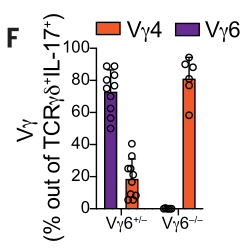
类似的,在IL-17+的肿瘤浸润γδT细胞中,Vγ6缺失也可显著地上调Vγ4的表达:
靶向Vγ4和Vγ6抑制肿瘤进展
为了进一步评估靶向Vγ4的抑制肿瘤发生的效应,研究者们在第二次DSS周期后每周给予anti-Vγ4治疗。结果表明,与Vγ6部分缺失相比,Vγ6完全缺失时anti-Vγ4治疗可以减小成瘤数量、大小及负荷:
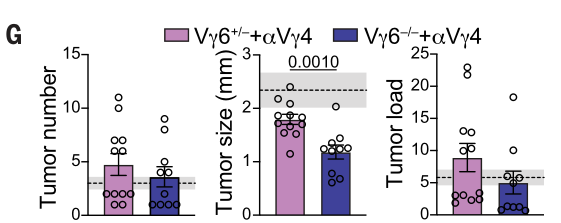
机制上,与Vγ6+/-小鼠相比,Vγ6-/-小鼠接受anti-Vγ4治疗可诱导肿瘤γδT细胞浸润减少:
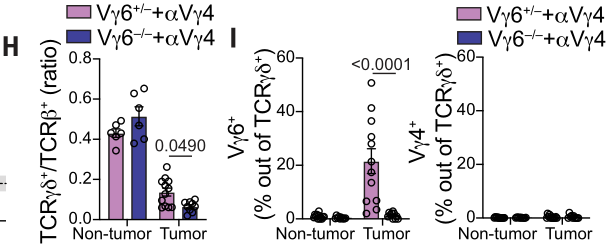
流式的结果表明,与Vγ6+/-小鼠相比,Vγ6-/-小鼠接受anti-Vγ4治疗可以上调肿瘤γδT细胞的CD8α表达(对INF-γ水平无明显影响),且极大地下调PD-1和IL-17表达:
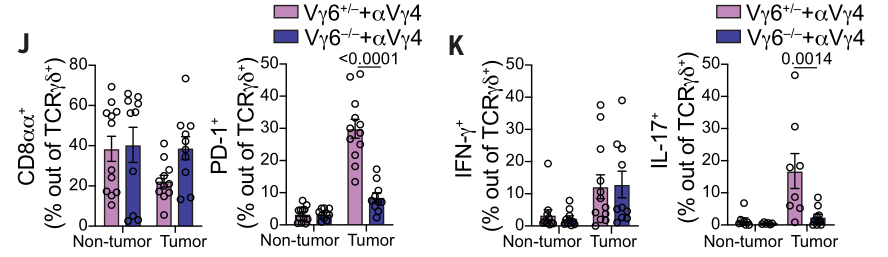
类似的,在IL-17+的肿瘤浸润γδT细胞中,anti-Vγ4治疗可显著抑制Vγ4表达,此效应不依赖Vγ6状态:
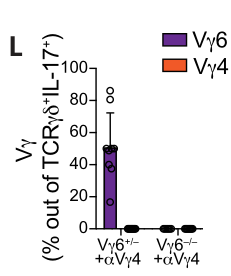
小结
本研究的主要创新点在于一个反经验的发现——即γδ T细胞对肿瘤作用的时间特异性。具体而言,即Vγ1/7 γδ T细胞调控肿瘤发生,而Vγ1/6 γδ T细胞调控肿瘤进展。γδ T细胞的功能状态似乎非常复杂多变,细胞-细胞相互作用也比较复杂,并且还与肠道菌群有密切关系(研究者们也没有确定具体哪个株参与γδ T细胞调控肿瘤的过程)。发现比较意外,留的坑也不小。在实验设计方面,作者发现γδ T细胞异质性的单细胞研究框架是比较普通的,没有什么特别的分析。测量T细胞功能主要依赖流式分选和流式细胞技术,在表征T细胞状态的过程也是使用经典的细胞毒性分子或免疫检查点分子,对具体通路没有特别研究(可能是比较明确;或者研究者觉得这个角度没有必要花很多心思去研究)。本研究所使用的动物模型多为转基因鼠,且是诱导自发肿瘤,动物实验的周期是比较长的(也比较贵),估计只有比较有钱、基础扎实的课题组才玩得起。作者发现γδ T细胞异质性的起点其实是基于单细胞测序的亚群分析,这个新技术在近来的CNS文章中已经成为“常规”技术(据我所知是个很烧钱的东西)。研究者表征肿瘤发生和肿瘤进展的思路还是很巧妙的,值得学习。
不过我也有几个点不太理解。比如,研究者在探究IL-17功能时为什么不使用IL-17转基因鼠,而要使用Rorγt转基因鼠呢?尽管Roryt是IL-17表达的关键调控转录因子,但也不排除Rorγt可能还参与了其它分子的调控。这在逻辑上似乎不是很严密。也许是Rorγt转基因鼠他们刚好有,或者Rorγt转基因鼠本来就是一个成熟的观察IL-17的模型?另外,研究者也构建了Vγ4转基因小鼠,但是没有看到与其相关的实验数据,不知道是不是漏了。最后,我觉得靶向γδ T细胞(亚群)的治疗策略在动物实验上的表现并不太惊艳,感觉临床转化的价值不高(估计基础研究的价值比较高吧)。
---------------
完结,撒花!如果您点一下广告,可以养活苯苯😍😍😍
