概览
- 本文围绕 前言 展开详细讨论
- 包含 15 个主要章节内容
- 文末提供总结与展望
前言
此文内容目前处于BETA版本
Mitochondrial RNA modifications shape metabolic plasticity in metastasis. Nature. From 德国癌症研究中心的Michaela Frye团队
全文资源:full.pdf.local; full.html; full.pdf.remote
Keywords: Metastasis-initiating cells, 转录起始细胞;5-methylcytosine, m5C, 5-甲基胞嘧啶;5-formylcytosine, f5C, 5-甲酰基胞嘧啶
技术
fCAB-seq
本研究进行了化学辅助亚硫酸氢盐测序 (fCAB-seq),这是一种使用 O-乙基羟胺来保护亚硫酸氢盐转化方案中的 f5C 位点的方法。详情可见此研究。
研究者为了检测线粒体 tRNA 中的 m5C 和 f5C,使用 Mirvana 试剂盒从总 RNA 中分离 tRNA,如制造商 (Thermo Fisher Scientific) 所述。如前所述进行 O-乙基羟胺和亚硫酸氢盐处理、文库制备和测序。
对于靶向基因特异性亚硫酸氢盐测序、RNA 分离、亚硫酸氢盐转化反应和测序,使用了大约 1-2μg 的 RNA 样品。为了识别 f5C 修饰,将 RNA 预暴露于 100 mM MES 缓冲液(pH 5.0)中的 10 mM O-乙基羟胺,在 37 °C 下 2 h,然后进行亚硫酸氢盐处理。对于 m5C,通过与 EpiTect Bisulfite Kit (Qiagen) 提供的 42.5 μl 40% 亚硫酸氢钠溶液 (pH 5.0) 和 17.5 μl DNA 保护缓冲液混合,对 RNA 进行亚硫酸氢盐处理。
Cell lines
- FaDu:FaDu 是一种具有上皮形态的细胞系,于 1968 年从一名患有鳞状细胞癌的 56 岁白人男性患者的下咽肿瘤穿孔活检中建立。该细胞系是合适的转染宿主,可用于癌症和免疫肿瘤学研究。
- VDH15:oral carcinoma cell line
- NHEK:normal human epithelial keratinocytes,正常的人上皮角质形成细胞
Molecules/inhibitors
- NSUN3: chr3:94,062,980-94,131,832(GRCh38/hg38); NOP2/Sun RNA Methyltransferase 3, 即NOP2/Sun RNA 甲基转移酶 3。属于线粒体 tRNA 甲基转移酶,介导 mt-tRNA(Met) 的第 34 位胞嘧啶甲基化为 5-甲基胞嘧啶 (m5C)。胞嘧啶 (34) 处的 mt-tRNA(Met) 甲基化发生在反密码子的摆动位置,并在该位置启动 5-甲酰基胞嘧啶 (f5c) 的形成。在摆动位置包含 f5c 修饰的 mt-tRNA(Met) 能够识别除 AUG 密码子之外的 AUA 密码子,从而扩展线粒体翻译中的密码子识别。
- ALKBH1: 即AlkB同源物1,或称组蛋白H2A双加氧酶。作用于核酸的双加氧酶,例如 DNA 和 tRNA。需要分子氧、α-酮戊二酸和铁。主要作为 tRNA 去甲基化酶,通过从各种 tRNA 中去除 N(1)-甲基腺嘌呤,优先选择 tRNA 茎环结构上存在的第 58 位的 N(1)-甲基腺嘌呤 (m1A58)。作为对葡萄糖剥夺反应的翻译起始和延伸的调节剂:通过介导 tRNA(Met) 的去甲基化和翻译延伸来调节翻译起始,含 N(1)-甲基腺嘌呤的 tRNA 被优先招募到多核糖体以促进翻译伸长率。在线粒体中,特异性地与 mt-tRNA(Met) 相互作用并介导 mt-tRNA(Met) 在胞嘧啶 (34) 处甲基化的氧化,从而在该位置形成 5-甲酰基胞嘧啶 (f5c) 。在摆动位置包含 f5c 修饰的 mt-tRNA(Met) 能够识别除 AUG 密码子之外的 AUA 密码子,从而扩展线粒体翻译中的密码子识别 。专门去甲基化腺嘌呤 (N(6)-甲基腺苷) DNA第 6 位甲基化的 DNA。 N(6)-甲基腺苷 (m6A) DNA 存在于胚胎干细胞的某些 L1 元素中,可能会促进它们的沉默(通过相似性)。对含有 N(3)-甲基胞苷修饰的 mRNA 进行去甲基化。还能够通过氧化去甲基化修复烷基化单链 DNA,但活性较低。还具有 DNA 裂解酶活性并在脱碱基位点引入双链断裂:在脱碱基位点切割单链 DNA 和双链 DNA,对具有两个脱碱基位点的双链 DNA 具有最大活性。 DNA 裂解酶活性不需要 α-酮戊二酸和铁,并导致与 5′ DNA 产物形成不可逆的共价蛋白-DNA 加合物。在 B 淋巴细胞活化期间,在碱基切除修复和免疫球蛋白重链的类别转换重组期间不需要 DNA 裂解酶活性。可能在胎盘滋养层谱系分化中起作用(通过相似性)。在本研究中,f5C34 的生物发生是通过NSUN3形成 m5C 开始的,并由 ALKBH1 完成。
- GLUT1:葡萄糖转运蛋白 1 型,亦称Solute Carrier Family 2 Member 1。促进葡萄糖转运蛋白,负责组成型或基础葡萄糖摄取。具有非常广泛的底物特异性;可以运输多种醛糖,包括戊糖和己糖。大脑最重要的能量载体:存在于血脑屏障并确保葡萄糖以独立于能量的方式促进转运到大脑中。与 BSG 和 NXNL1 结合,通过增加对光感受器的葡萄糖摄取(通过相似性)促进视网膜视锥存活。 在本研究中,GLUT1高表达作为糖酵解上调的标志之一。
- TOMM20: Translocase Of Outer Mitochondrial Membrane 20, 线粒体外膜转位酶 20。受体复合物的核心成分,负责识别和转运胞质合成的线粒体前蛋白。与 TOM22 一起作为线粒体外膜表面的转运肽受体,促进前蛋白移动到 TOM40 易位孔中(通过相似性)。细胞色素 P450 单加氧酶穿过线粒体外膜易位所必需的。在研究中主要作为识别线粒体的标志物(免疫荧光法)。
- phalloidin: 鬼笔环肽。其可结合 F-肌动蛋白,防止其解聚并产生细胞毒性作用。鬼笔环肽在 F-肌动蛋白亚基之间的界面处特异性结合,将相邻的亚基锁定在一起。鬼笔环肽是一种双环七肽,与肌动蛋白丝的结合比与肌动蛋白单体更紧密地结合,导致肌动蛋白亚基从丝端解离的速率常数降低,这基本上通过防止丝解聚来稳定肌动蛋白丝。 鬼笔环肽可抑制 F-肌动蛋白的 ATP 水解活性。总体而言,发现鬼笔环肽与肌动蛋白发生化学计量反应,强烈促进肌动蛋白聚合,并稳定肌动蛋白聚合物。 当以低浓度引入细胞质时,鬼笔环肽将细胞质肌动蛋白的聚合程度较低的形式以及细丝蛋白募集到聚集肌动蛋白聚合物的稳定“岛”中,但它不会干扰应力纤维,即微丝的粗束 。在较高浓度下,鬼笔环肽会诱导细胞收缩。在本研究中,phalloidin主要作为细胞骨架背景色对线粒体进行衬托?
- CD36:也称为血小板糖蛋白 4、脂肪酸转位酶 (FAT)、清道夫受体 B 类成员 3 (SCARB3) 和糖蛋白 88 (GP88)、IIIb (GPIIIB) 或 IV (GPIV),是一种在人类中由 CD36 基因编码的蛋白质。 CD36 抗原是一种完整的膜蛋白,存在于脊椎动物许多细胞类型的表面。它在细胞内导入脂肪酸,是细胞表面蛋白 B 类清道夫受体家族的成员。 CD36 结合许多配体,包括胶原蛋白、血小板反应蛋白、寄生于恶性疟原虫的红细胞、氧化低密度脂蛋白、天然脂蛋白、氧化磷脂、和长链脂肪酸。在转基因啮齿动物中的研究表明 CD36 在脂肪酸代谢、心脏病、味觉和肠道中的膳食脂肪加工中发挥作用。 它可能与葡萄糖耐受不良、动脉粥样硬化、动脉高血压、糖尿病、心肌病、阿尔茨海默病和各种癌症有关,主要是上皮来源的癌症(乳腺癌、前列腺癌、卵巢癌和结肠癌)以及肝癌和神经胶质瘤。在本研究中,CD36属于转移起始细胞的标记物。
- CD44:CD44 抗原是一种细胞表面糖蛋白,参与细胞间相互作用、细胞粘附和迁移。在人类中,CD44 抗原由 11 号染色体上的 CD44 基因编码。CD44 被称为 HCAM(归巢细胞粘附分子)、Pgp-1(吞噬糖蛋白-1)、Hermes 抗原、淋巴细胞归巢受体、ECM-III 和 HUTCH-1。在本研究中,CD44是转移起始细胞的标记物。
- K10:即Keratin 10,角蛋白10。Keratin-10 是 I 型(酸性)细胞角蛋白家族的成员,属于中间丝 (IF) 蛋白的超家族。角蛋白是形成中间丝的杂聚结构蛋白。这些细丝与肌动蛋白微丝和微管一起构成上皮细胞的细胞骨架。该基因的突变与表皮松解性角化过度有关。该基因位于染色体 17q21 上的角蛋白家族成员簇内。在本研究中,K10是细胞骨架的标记(免疫荧光)。
- FLG:Filaggrin, 丝聚合蛋白。在哺乳动物表皮的终末分化过程中,聚集角蛋白中间丝并促进中间丝之间的二硫键形成。在本研究中,FLG是细胞骨架的标记(免疫荧光)。
- KRT8: 角蛋白II型细胞骨架8;与 KRT19 一起,有助于将收缩装置与横纹肌肋骨处的肌营养不良蛋白联系起来。
- Ampicillin (AMP) and amoxicillin (AMOX), linezolid (LIN), chloramphenicol (CAP), tigecycline (TIG) or doxycycline (DOX) 氨苄西林 (AMP) 和阿莫西林 (AMOX)、利奈唑胺 (LIN)、氯霉素 (CAP)、替加环素 (TIG) 或强力霉素 (DOX)
呼吸相关
Oxygen consumption rate (OCR) 耗氧率
有空啃啃生化再详解
- Oligomycin:寡霉素,一种ATP合成酶抑制剂
- FCCR:线粒体氧化磷酸化的强效解偶联剂。 FCCP 将质子转运穿过线粒体内膜来干扰质子梯度从而破坏ATP合成。
- Rotenone: 鱼藤酮;干扰线粒体的电子传递链
- 2DG-IR:2-Deoxy-d-Glucose-IR, 2-脱氧-d-葡萄糖。本研究中用于衡量细胞的糖摄取水平。
结果
检测线粒体tRNA转录组中的m5C和f5C位点
感觉这部分内容属于既往文献报导过的内容,并没有太多创新点
既往文献报导NSUN3(线粒体 tRNA 甲基转移酶)可介导tRNAMet 的第 34 位胞嘧啶甲基化为m5C; 而ALKBH1这一双加氧酶负责氧化tRNAMet 的第 34 位的m5C并形成f5C。所以后面作者的研究工作基本上是围绕这两个分子展开。
通过fCAB-Seq检测tRNA转录组中的m5C和f5C位点,研究者们发现tRNAMet 是唯一携带f5C的线粒体 tRNA。另外一个位点对应于tRNASer2,但它不携带f5C,只在可变循环中包含三个NSUN2介导的连续m5C位点。tRNAMet 携带f5C在正常的人上皮角质形成细胞或肿瘤细胞中均可观察到,并且sh-NSUN3可导致tRNAMet34位的f5C水平下调:
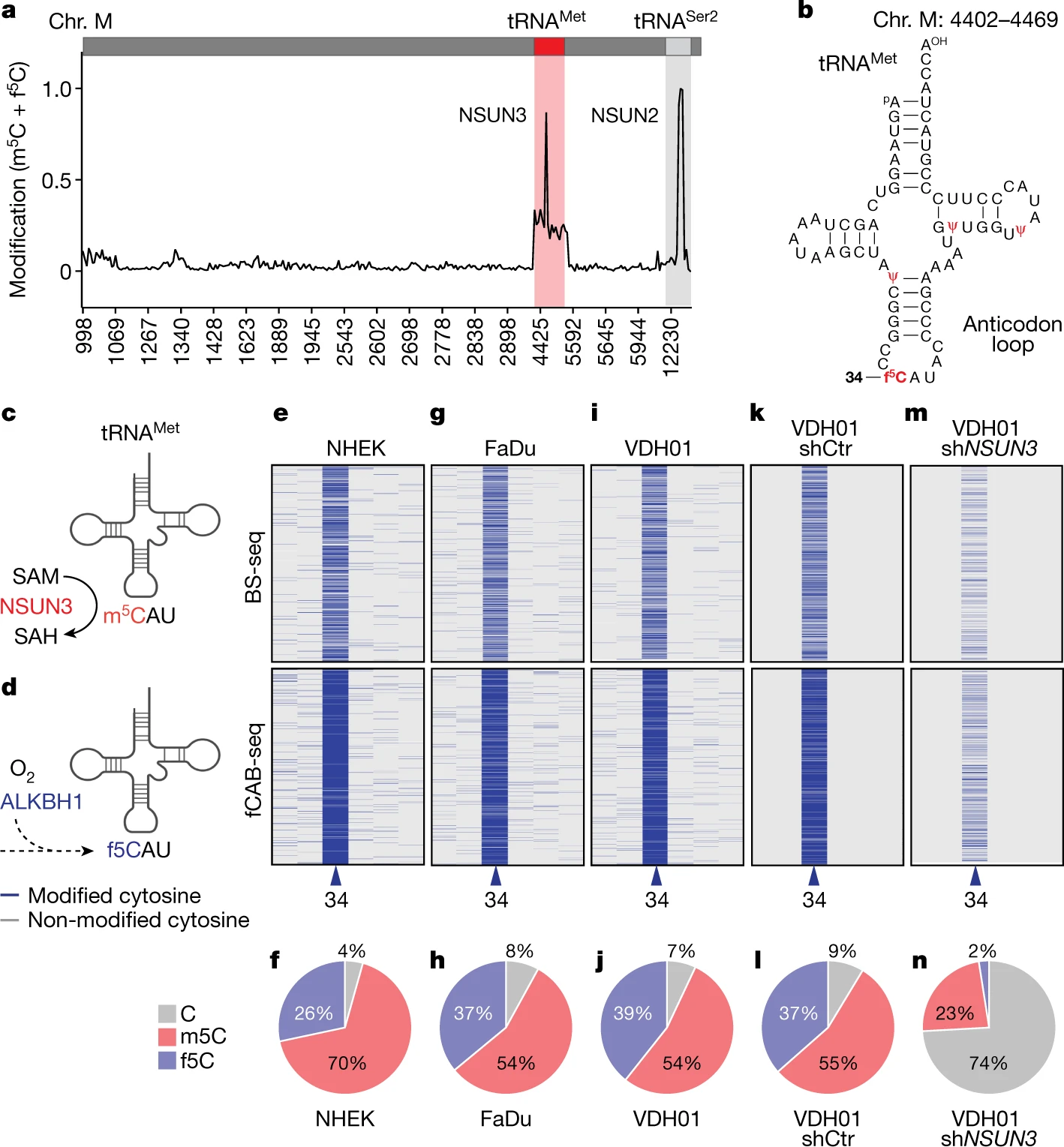
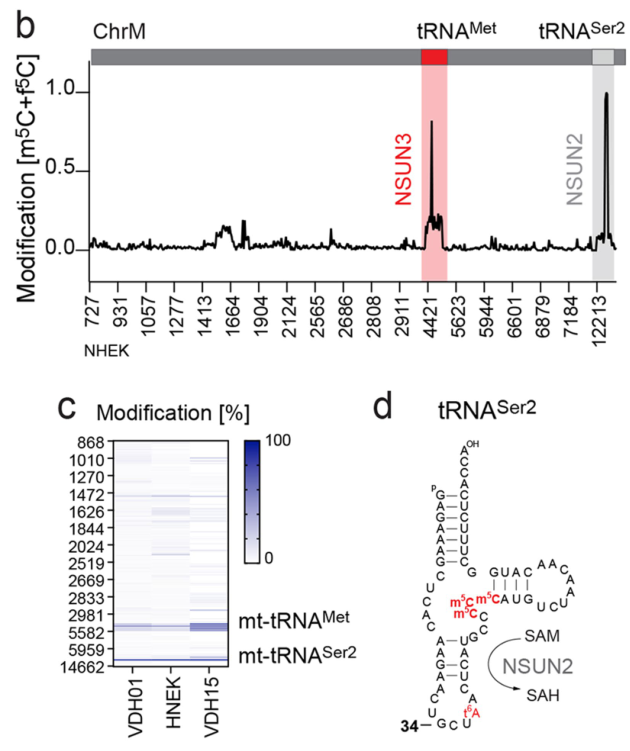
线粒体m5C控制肿瘤细胞的能量代谢
全方位探究NSUN3对线粒体形态和功能的影响
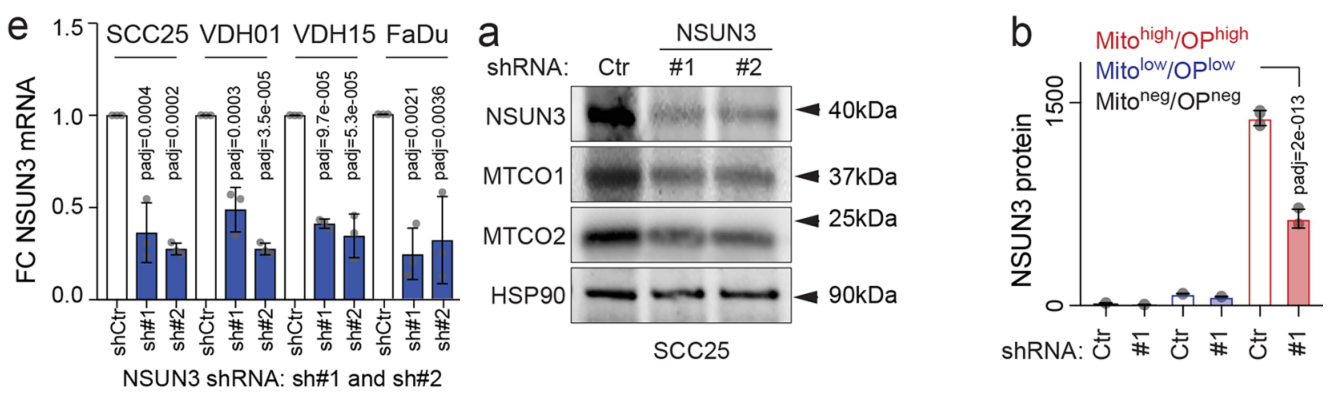
研究者先构建NSUN3 Knockdown稳转株,RNA和蛋白质水平共同验证:
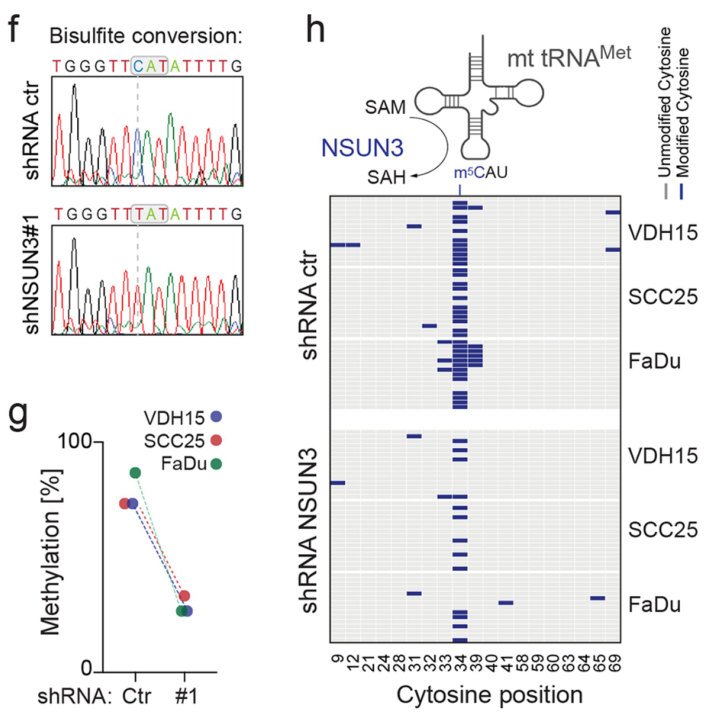
发现在多株肿瘤细胞中,NSUN3受抑制后tRNAMet的f5C信号减弱:
与正常的人上皮角质形成细胞相比,ALKBH1和NSUN3在组织/细胞中均高表达,且两者表达呈较强的正相关:
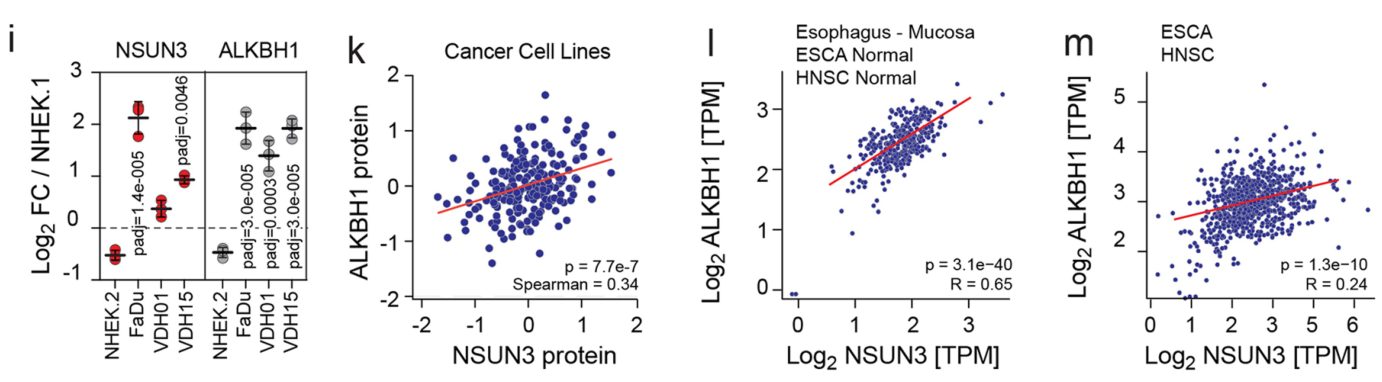
由于既往研究报道ALKBH1在f5C形成过程中的关键作用,因此为了确定NSUN3受抑制后是否可能通过调控ALKBH1发挥作用,研究者观察了ALKBH1的动态变化,发现NSUN3受抑制后对ALKBH1表达无明显影响:
非常经典的混杂因素控制策略。您细品。
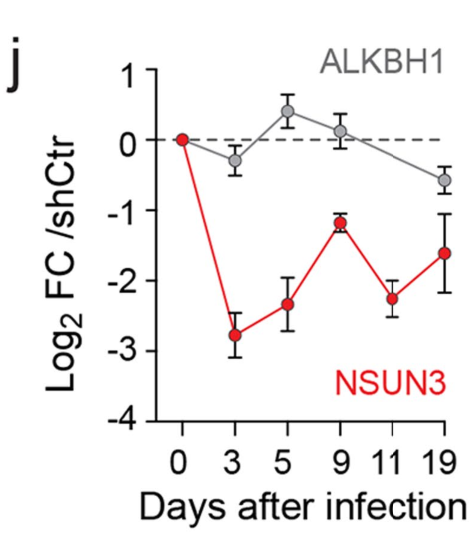
所以后面作者基本上就将sh-NSUN3当作调控线粒体m5C的手段进行进一步研究。
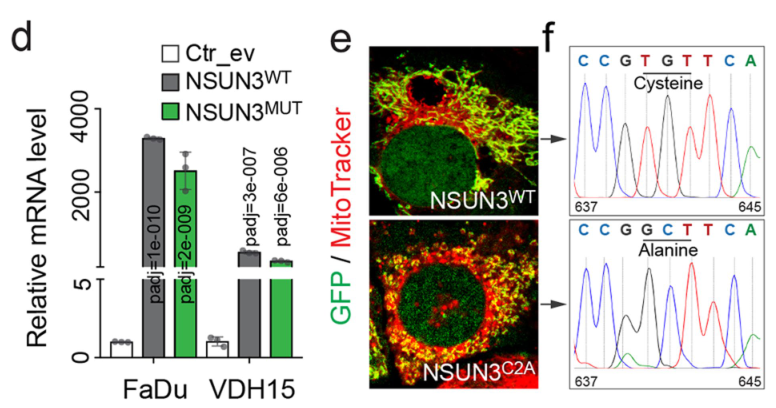
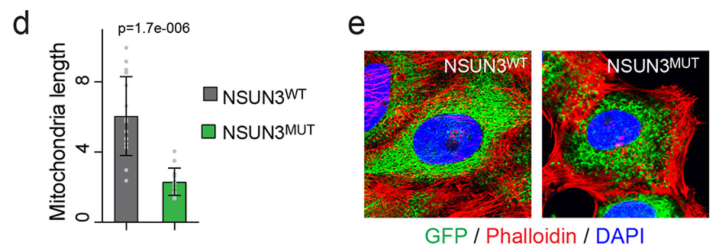
除了敲低株,研究者还构建了过表达NSUN3 WT和NSUN3失活(Mut)的细胞株,发现NSUN3失活后线粒体代偿性增加、形态发生变化,这也说明了NSUN3对线粒体具有调控作用:
不太确定下列结果是否反映了该结论
除了形态学上,研究者还从功能学上(蛋白合成、TCA代谢物水平、OCR、ECAR、氧化磷酸化/糖酵解水平)探究NSUN3对线粒体的影响。
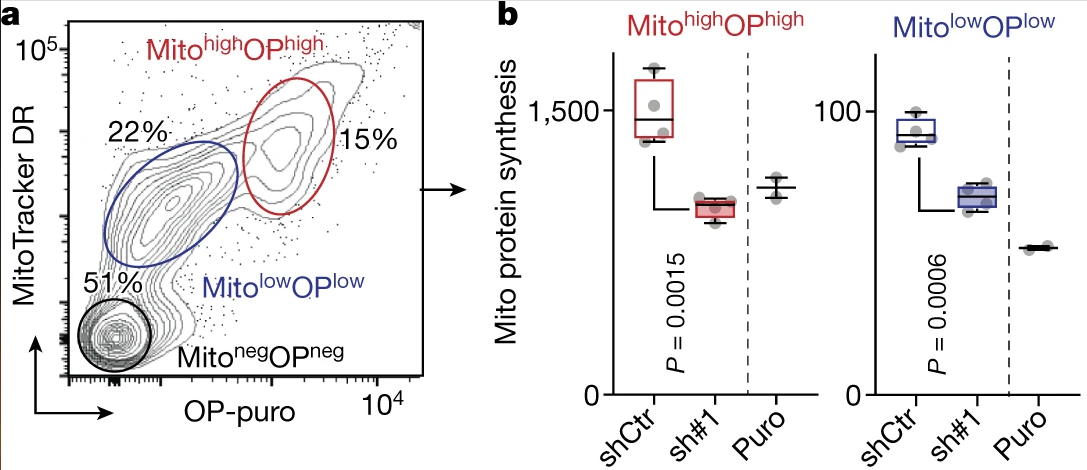
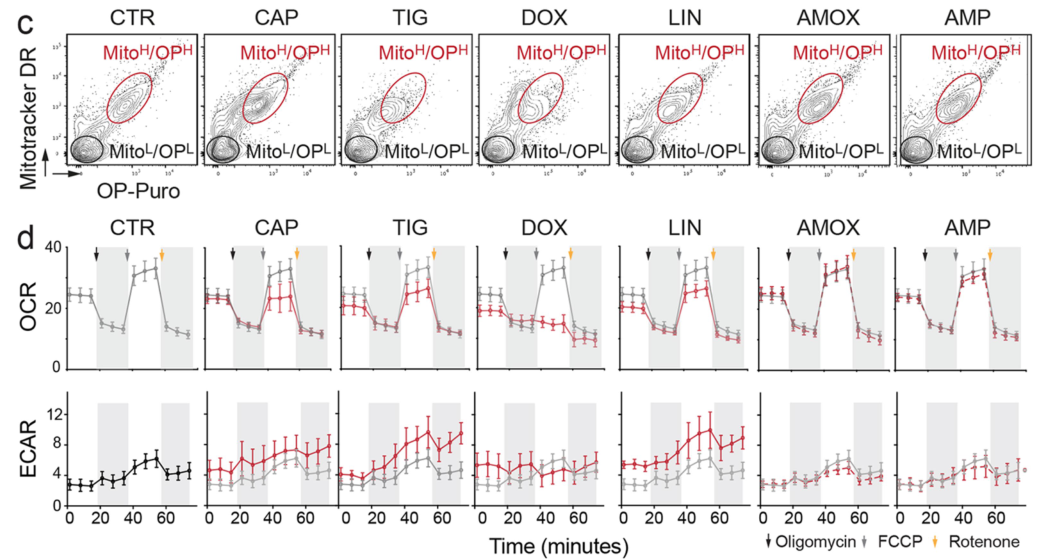
通过MitoTracker DR (Mito)和OP-puro (OP)结合流式分离线粒体,研究者发现sh-NSUN3可抑制线粒体蛋白合成:
嘌呤霉素是一种由白黑链霉菌产生的核苷类抗生素,其可打乱核糖体上的肽转运,造成翻译过程中不成熟链终止,从而抑制蛋白质合成。在下列实验中,嘌呤霉素主要充当阳性对照。
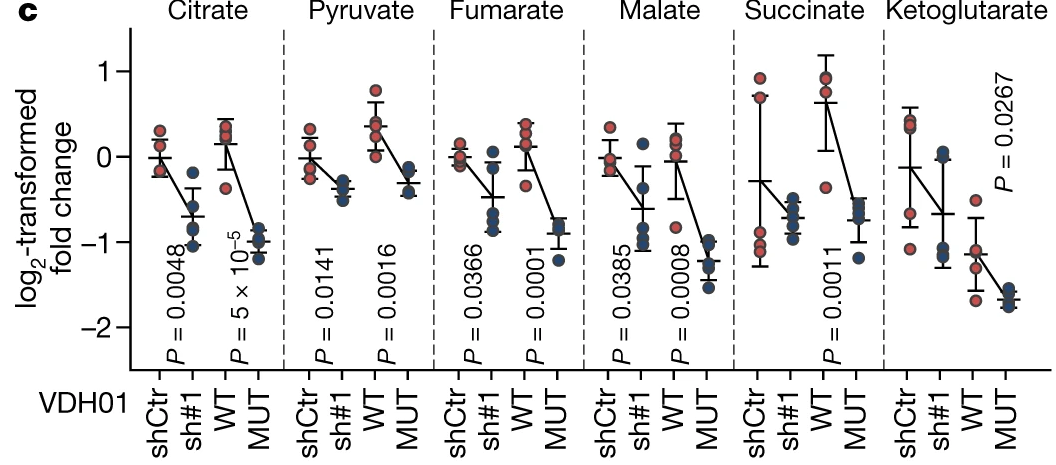
NSUN3受抑制后,TCA代谢物的水平也显著下降:
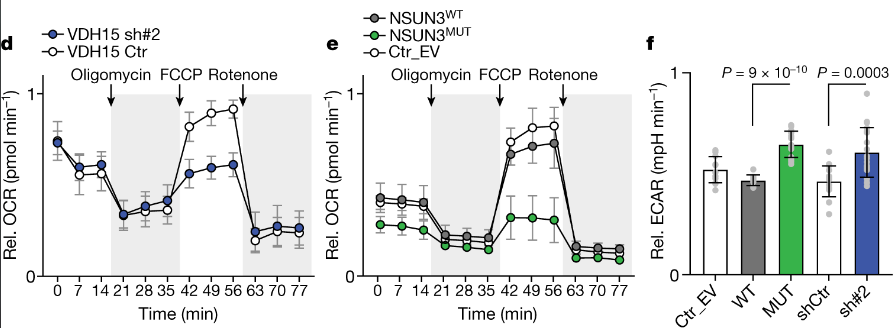
NSUN3受抑制后,Oxygen consumption rate (OCR)显著下降,而basal extracellular acidification rate (ECAR)则有所上调:
Oligomycin/FCCP/Rotenone的对应作用?
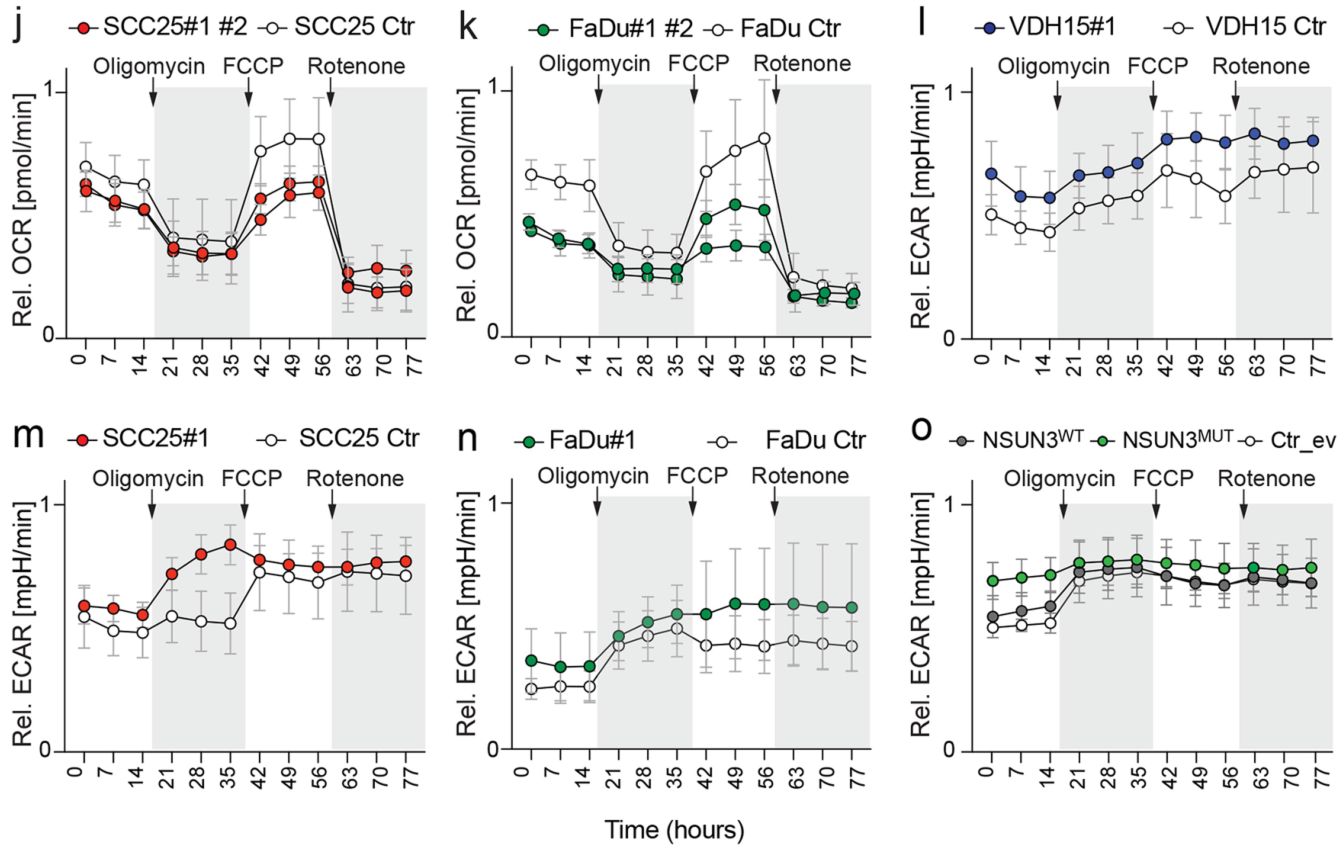
Metabolic flux analysis表明NSUN3受抑制后肿瘤细胞的氧化磷酸化水平下降,糖酵解的水平上升:
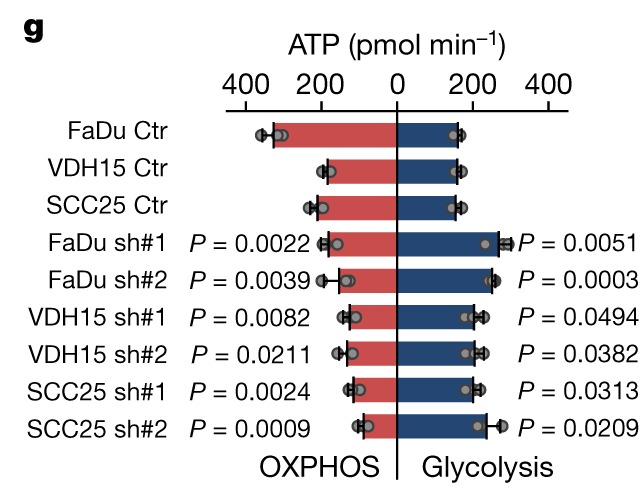
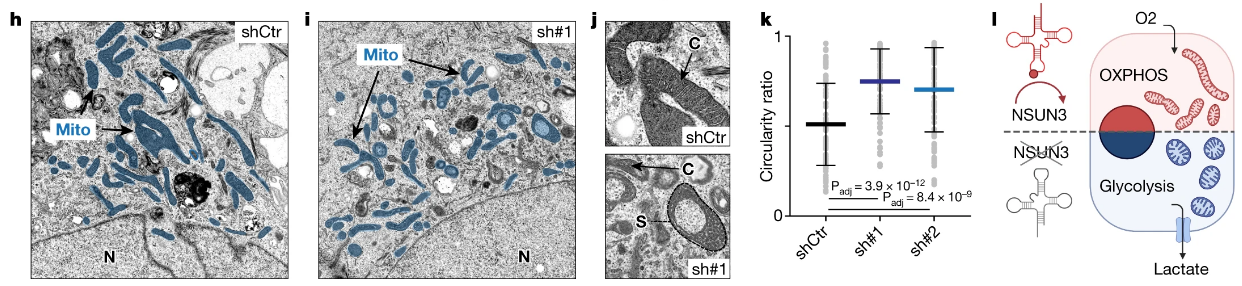
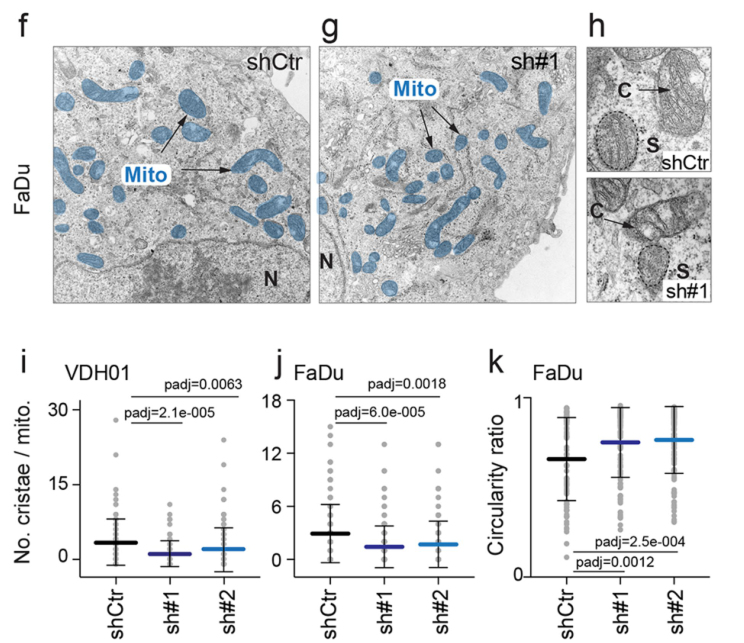
形态学观察表明NSUN3受抑制后线粒体出现显著圆化,线粒体嵴数量也显著降低:
the morphology of mitochondria in NSUN3-deficient cells appeared more circular and the number of cristae per mitochondrion was decreased (Fig. 2h–k and Extended Data Fig. 3f–k).
转移需要线粒体m5C
上述研究结果表明NSUN3对线粒体的tRNA-m5C修饰、线粒体形态和线粒体功能均有影响,但对肿瘤增殖、凋亡似乎并无明显影响。那么,NSUN3是否可能调控肿瘤转移呢?于是就有了这一部分的研究
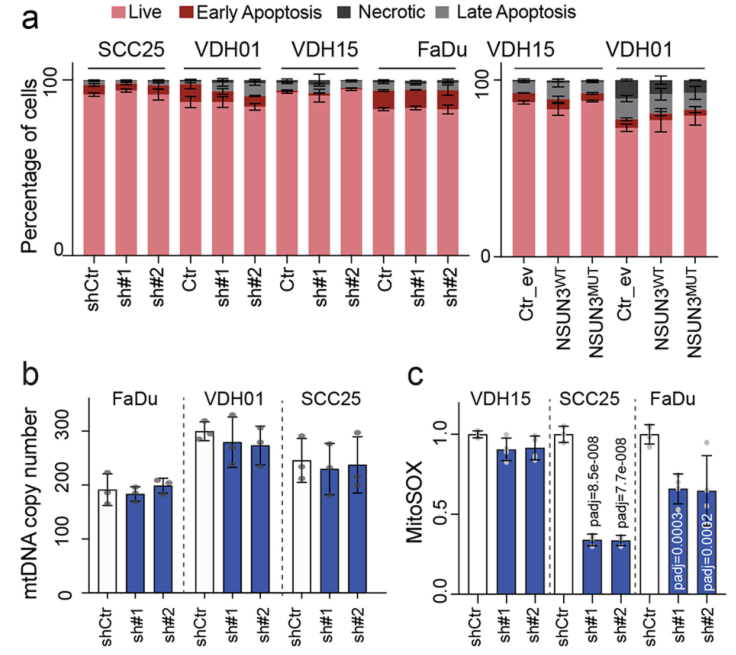
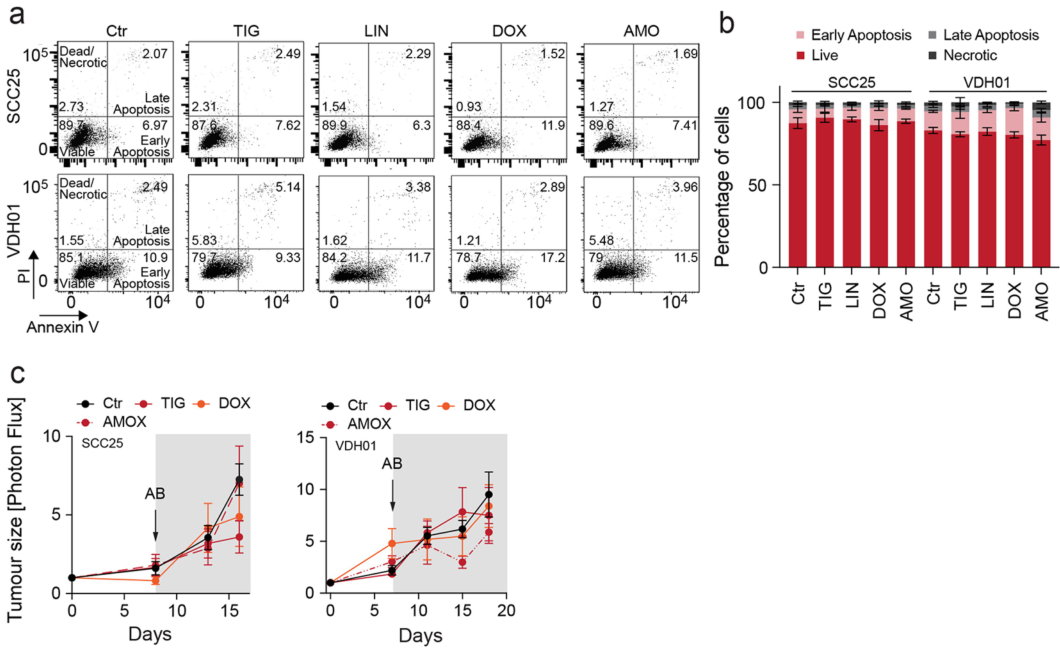
尽管影响线粒体功能,NSUN3受抑制后对肿瘤细胞凋亡、mtDNA拷贝数和活性氧水平却无明显影响:
通过对原位瘤CD44/MTCO1/MTCO2水平、3D环境生存状态、葡萄糖摄取(2DG-IR)的分析,发现NSUN3对原位瘤生长的影响较小:
看不太懂这里的实验设计逻辑
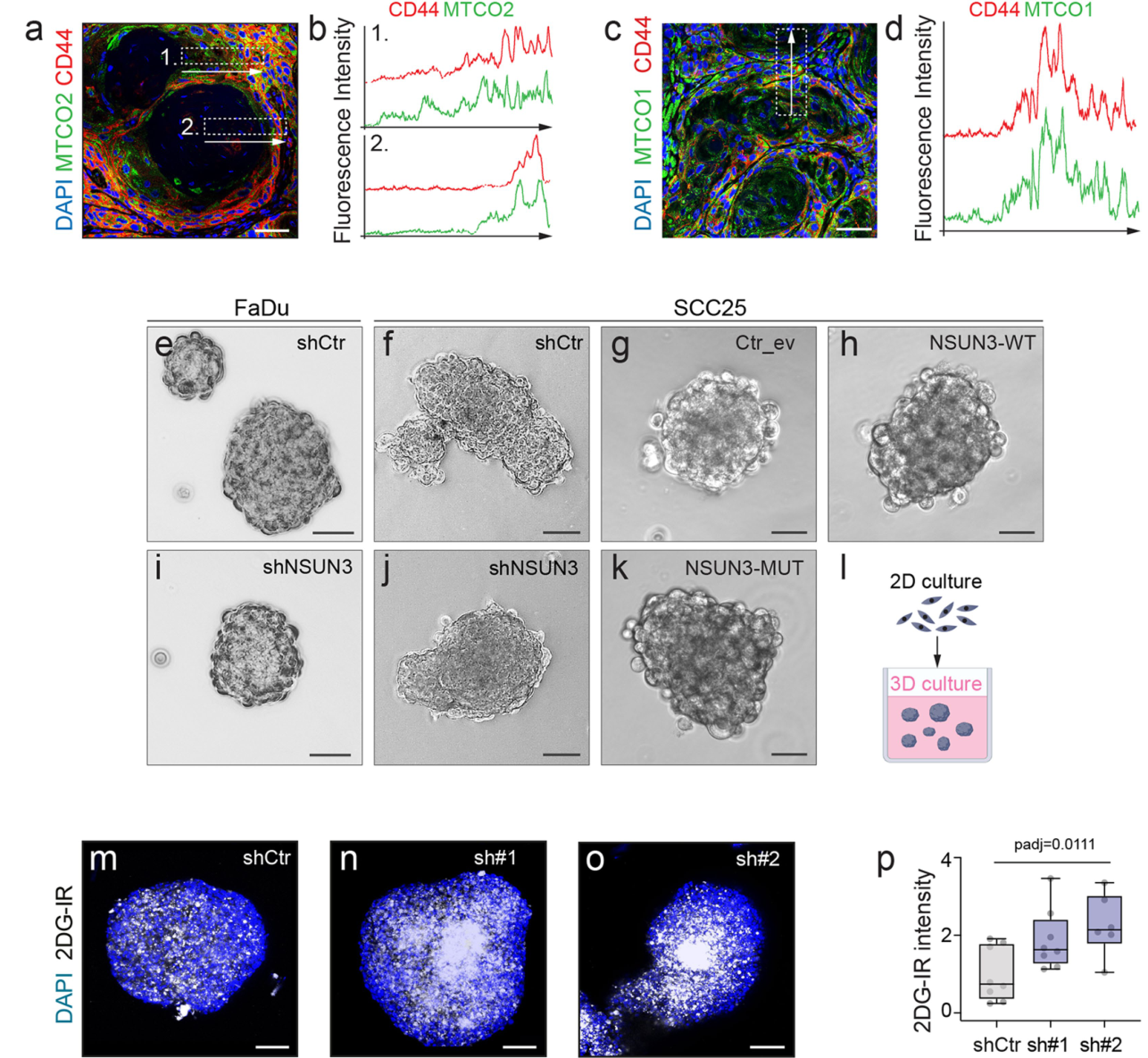
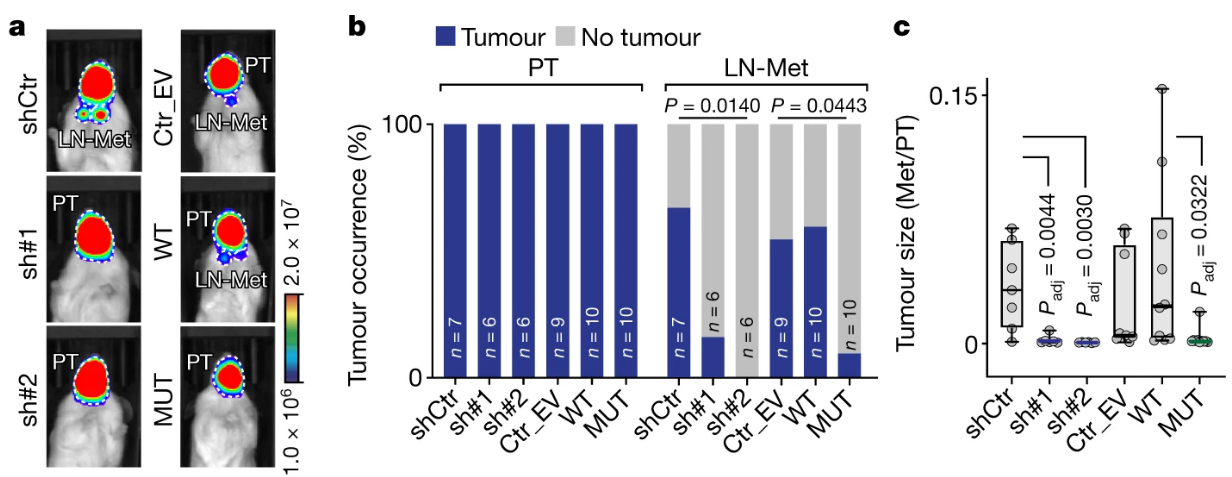
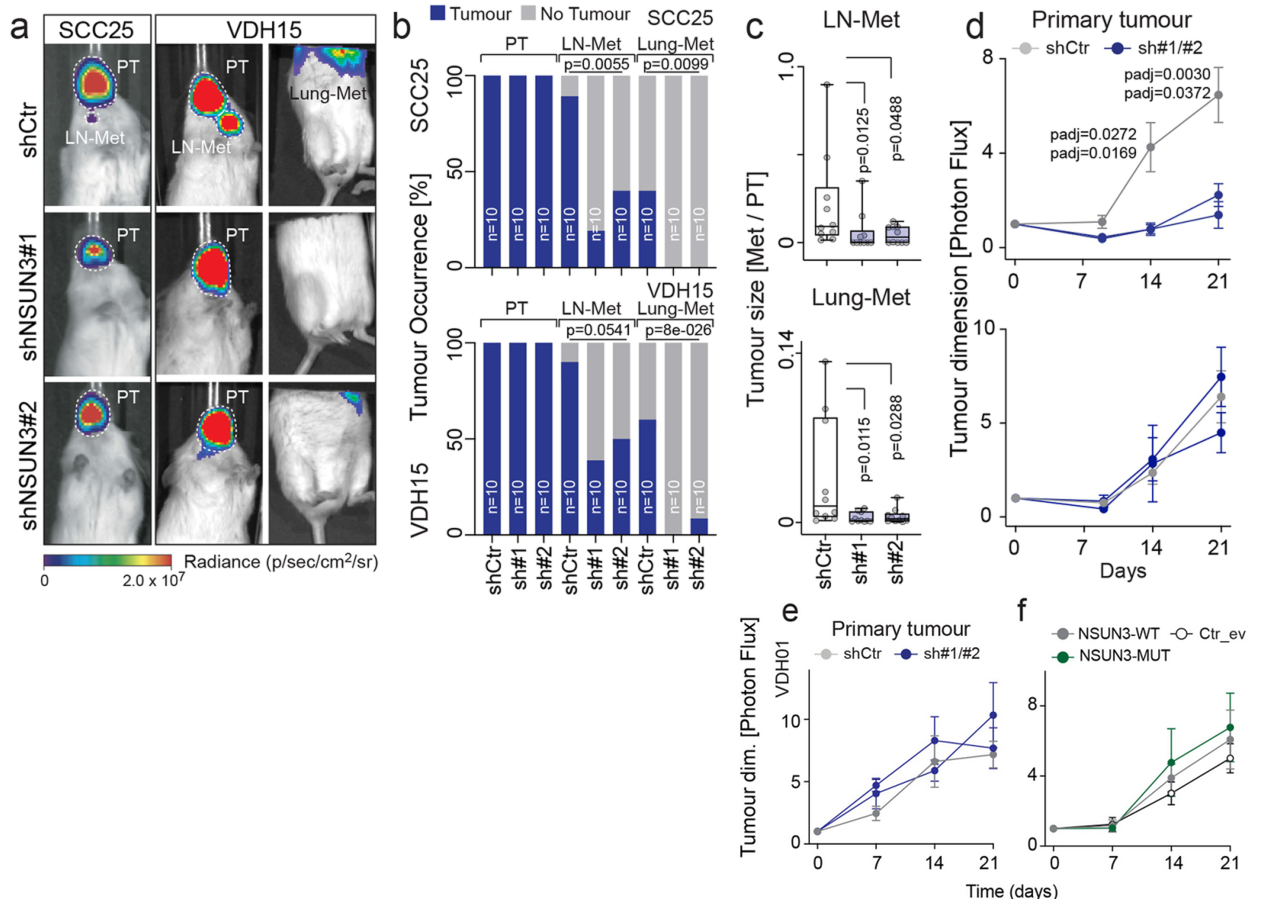
尽管原位瘤体积仍很大,NSUN3受抑制或失活后,肿瘤细胞转移事件的频率显著下降:
尽管以往也有类似报道,但与临床直觉并不太一致。持保留态度。
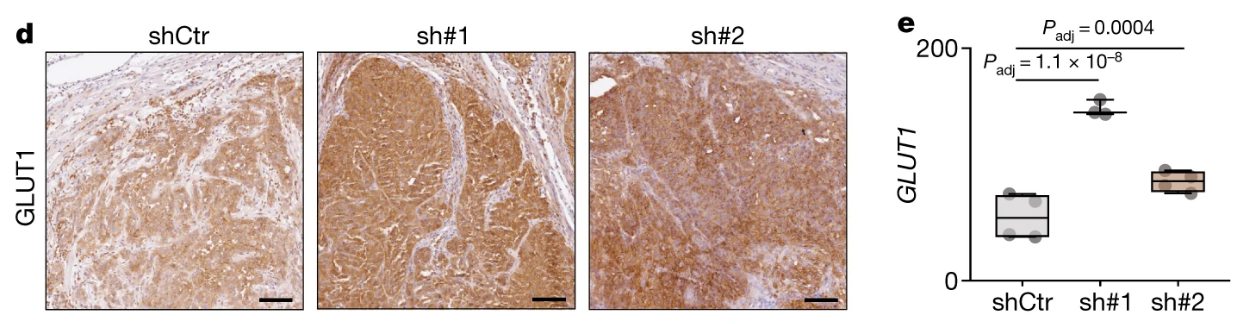
肿瘤移植瘤的IHC分析表明NSUN3受抑制后肿瘤细胞GLUT1表达水平升高,间接反映糖酵解水平上调:
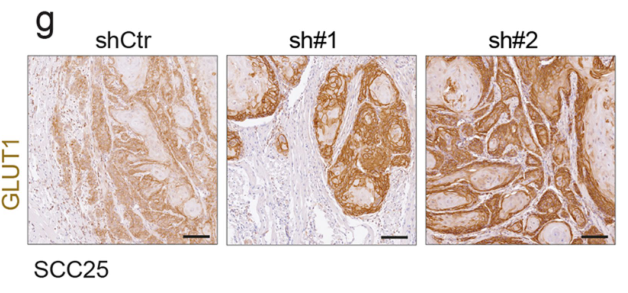
下列一波组学分析比较简单,算常规操作
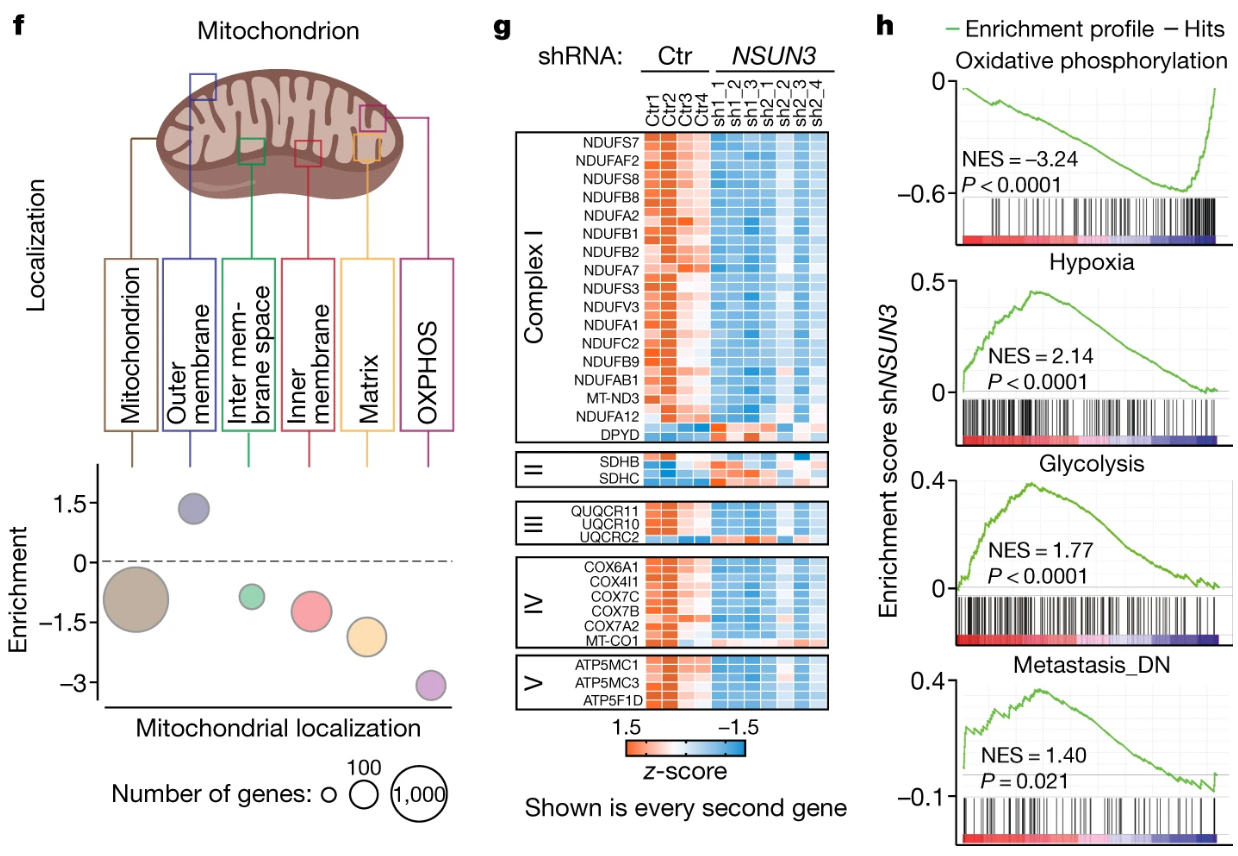
RNA-Seq数据表明NSUN3受抑制后线粒体相关通路基因表达下调:
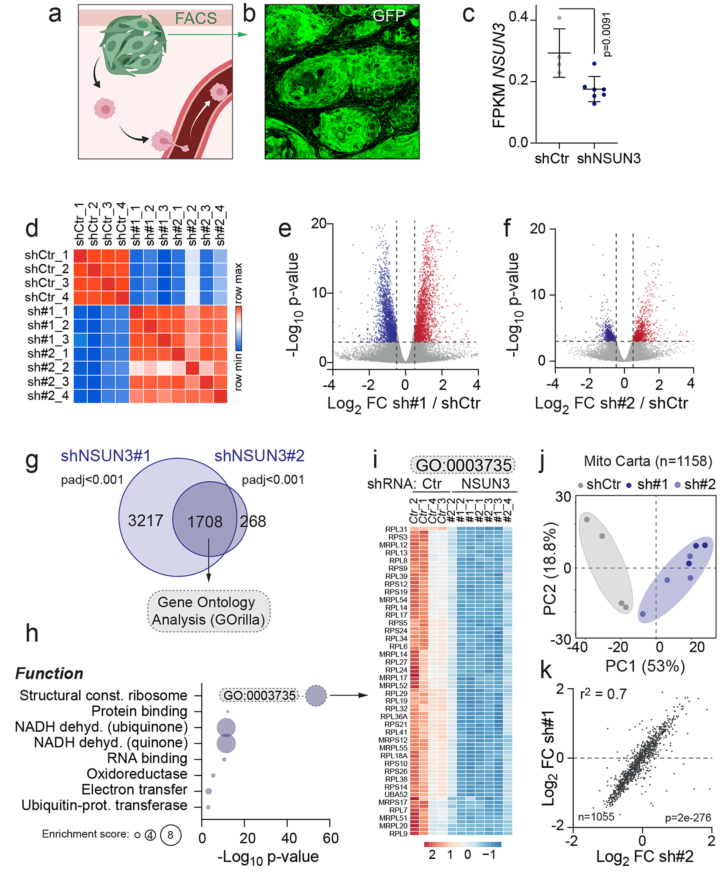
GSEA分析表明NSUN3受抑制后线粒体调节因子表达普遍下调、氧化磷酸化相关基因表达下调,而缺氧、糖酵解和转移相关通路表达上调,这也间接表明NSUN3受抑制后线粒体功能受损:
转移相关通路的趋势是否有疑问?
高效的线粒体翻译促进侵袭
前面的研究基本上已经明确NSUN3与肿瘤转移及线粒体功能失调的关系,这部分内容主要是为了深化机制研究,即NSUN3是如何调控肿瘤转移的。作者是通过转移前细胞和肿瘤细胞侵袭伪足两个方面进行论述,对于一般的肿瘤侵袭/转移研究来说并不常见。
基于3D培养的空间线粒体活性分析表明线粒体活性在类肿瘤的外围细胞中较高:
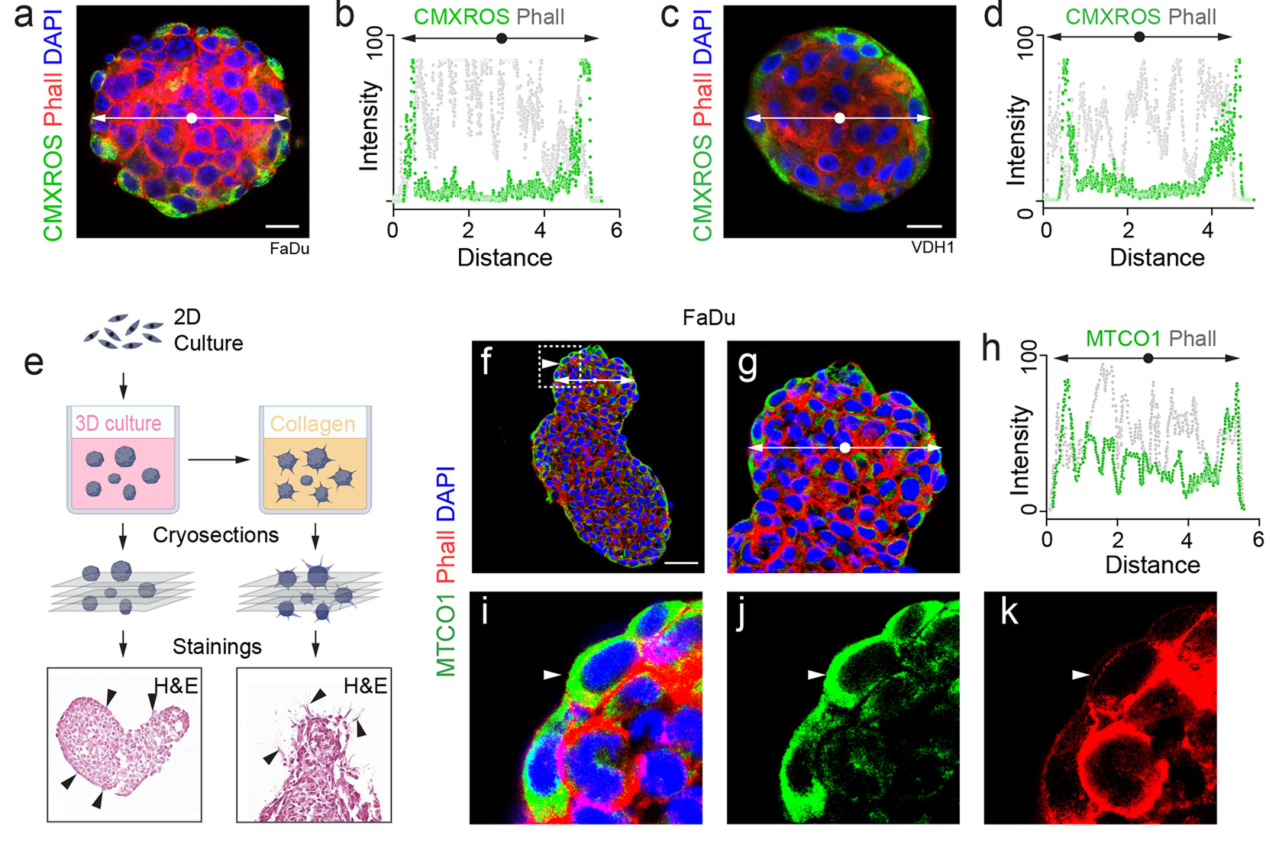
在3d培养时,NSUN3抑制可导致类肿瘤外围细胞的线粒体密度降低:
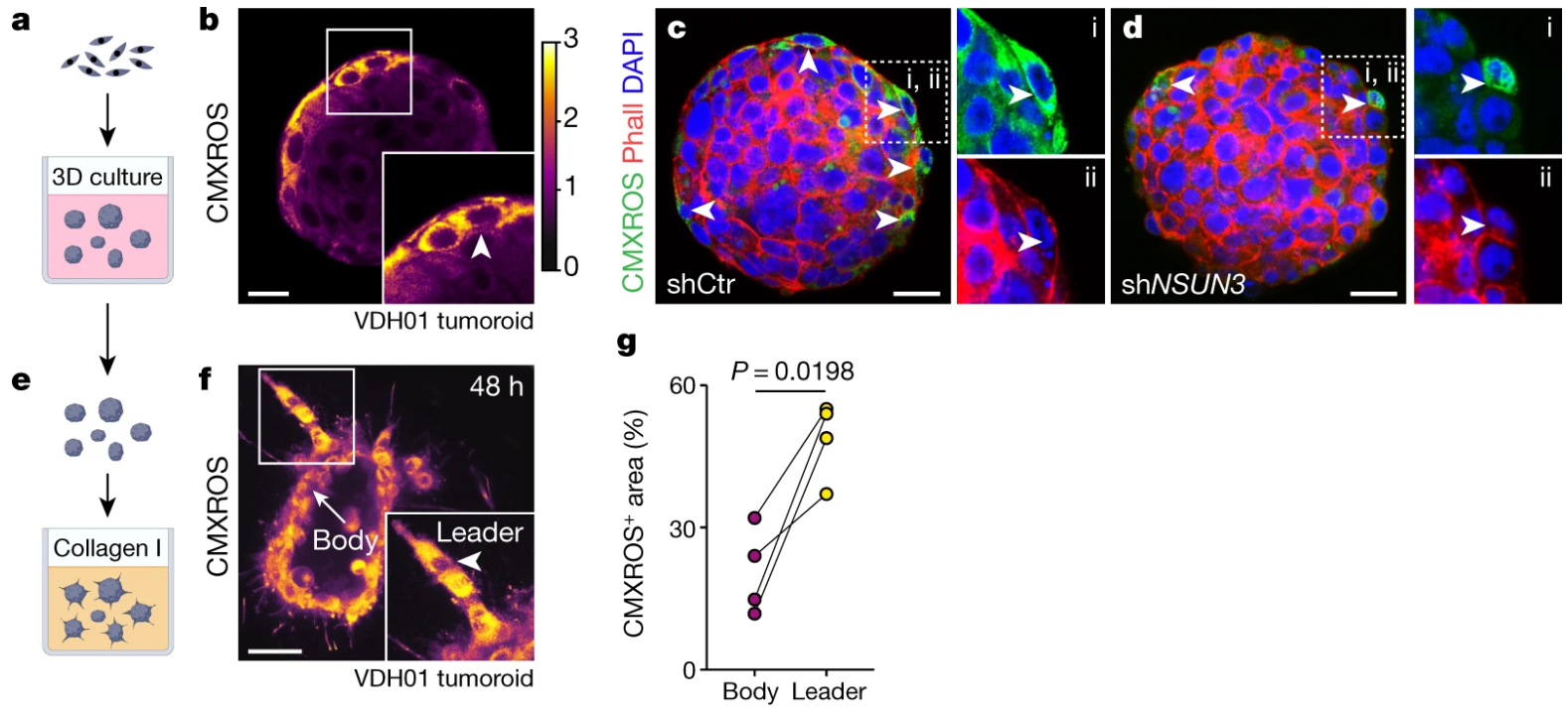
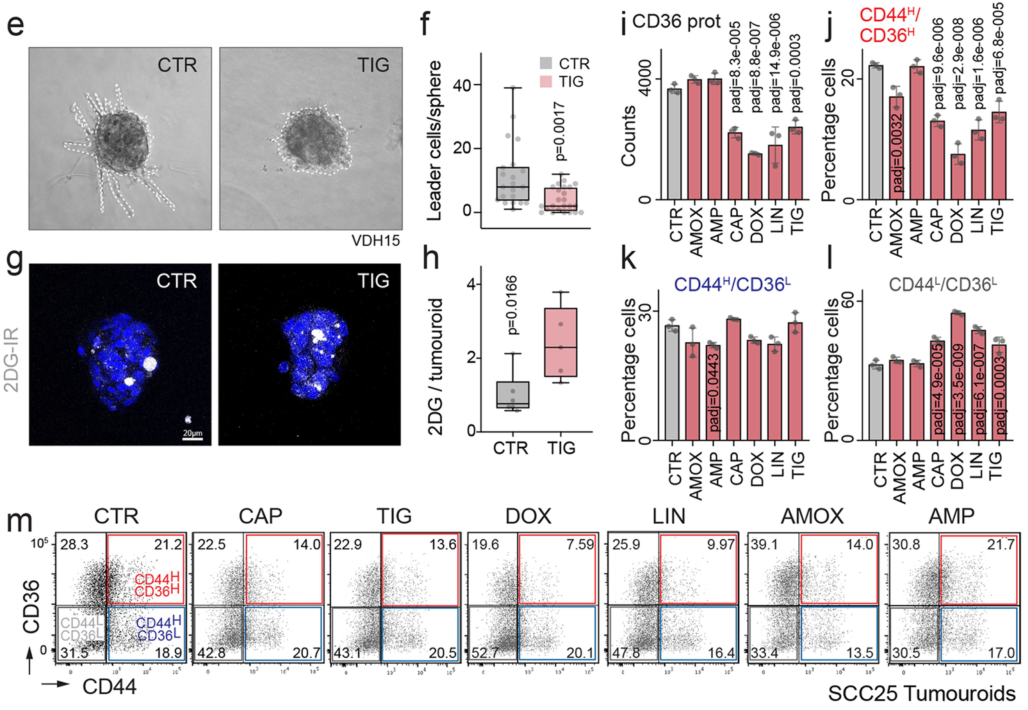
在Collagen I刺激下,NSUN3抑制可导致类肿瘤外围负责向周围组织侵袭的Leader细胞数量显著下降、线粒体长度变短:
Collagen I属于细胞外基质成分,它的作用类似于给肿瘤细胞提供一个抓点;而伪足就像手一样,从而实现“抓行”(侵袭)
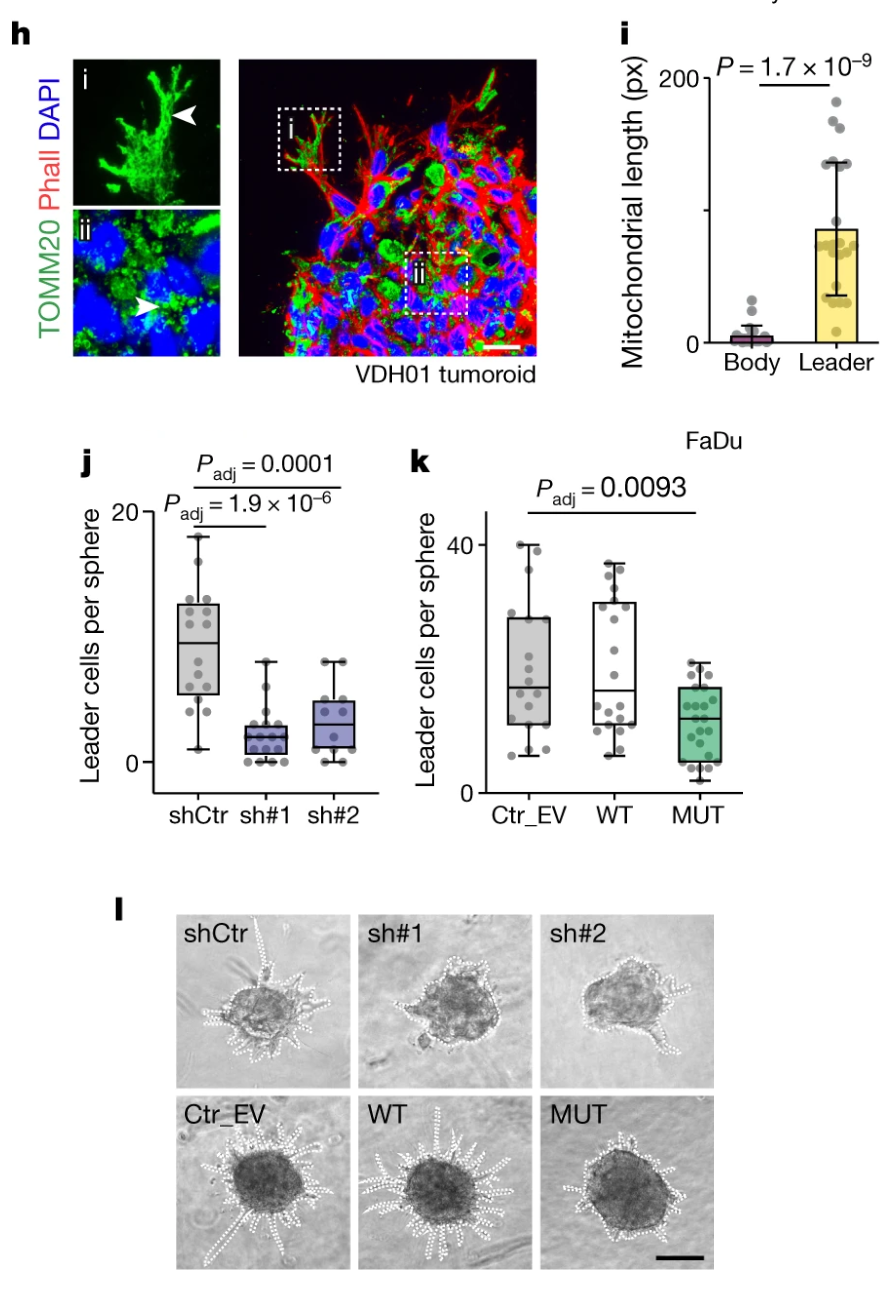
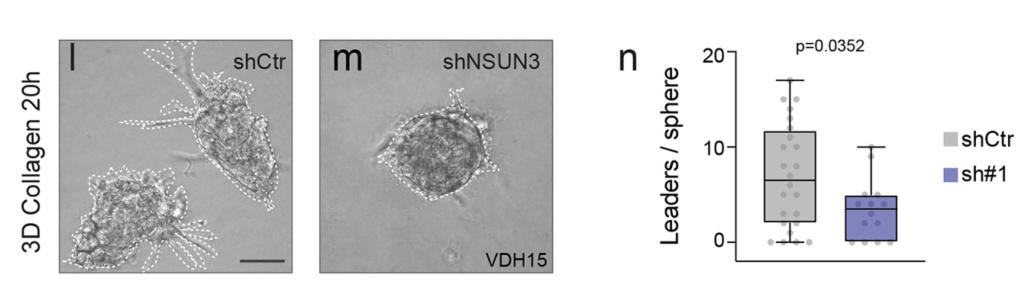
转移起始细胞需要线粒体tRNA甲基化
上一部分已经表明NSUN3参与了肿瘤细胞的侵袭,这一部分是从另一个角度衡量NSUN3对转移的影响——转移起始细胞。
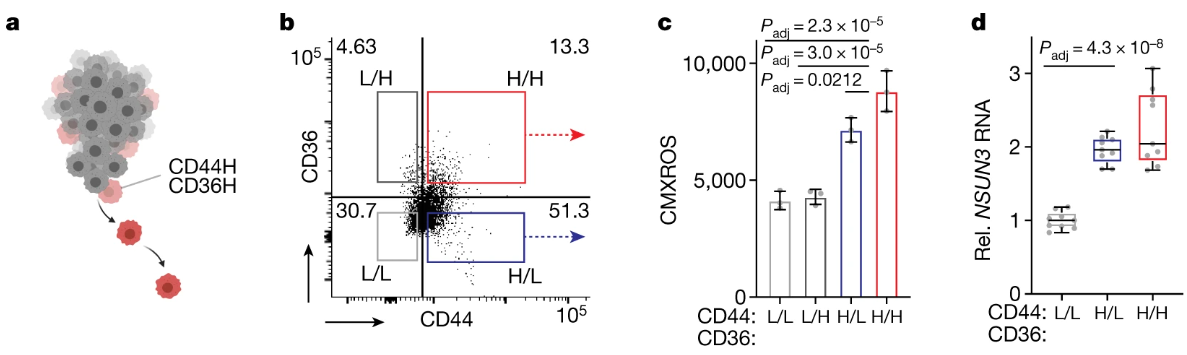
共表达细胞表面标志物CD44 和CD36的非分裂肿瘤细胞亚群已被确定为人类口腔癌中的转移起始细胞。由于 CD36 位于线粒体外膜上,所以研究者测试了高表达 CD44 和 CD36 的肿瘤细胞亚群是否与线粒体功能相关。
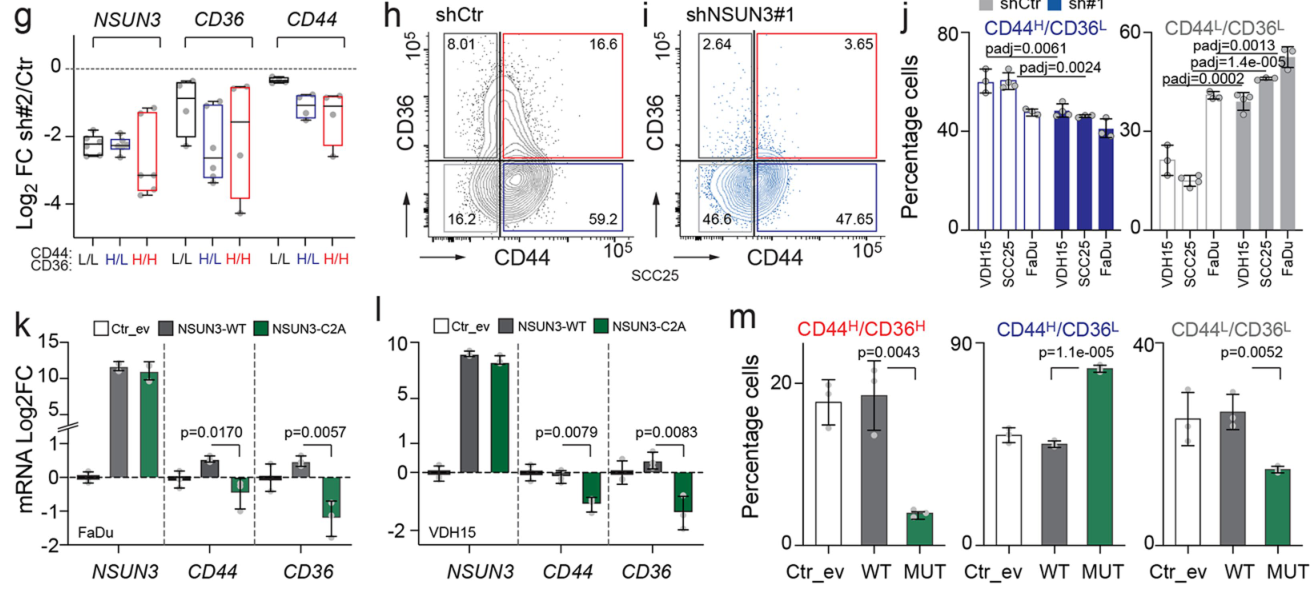
研究表明NSUN3受抑制后CD44阳性细胞比例下降,中间丝相关蛋白K10和FLG阳性细胞无明显变化,这说明NSUN3抑制对肿瘤细胞组织学无明显改变:
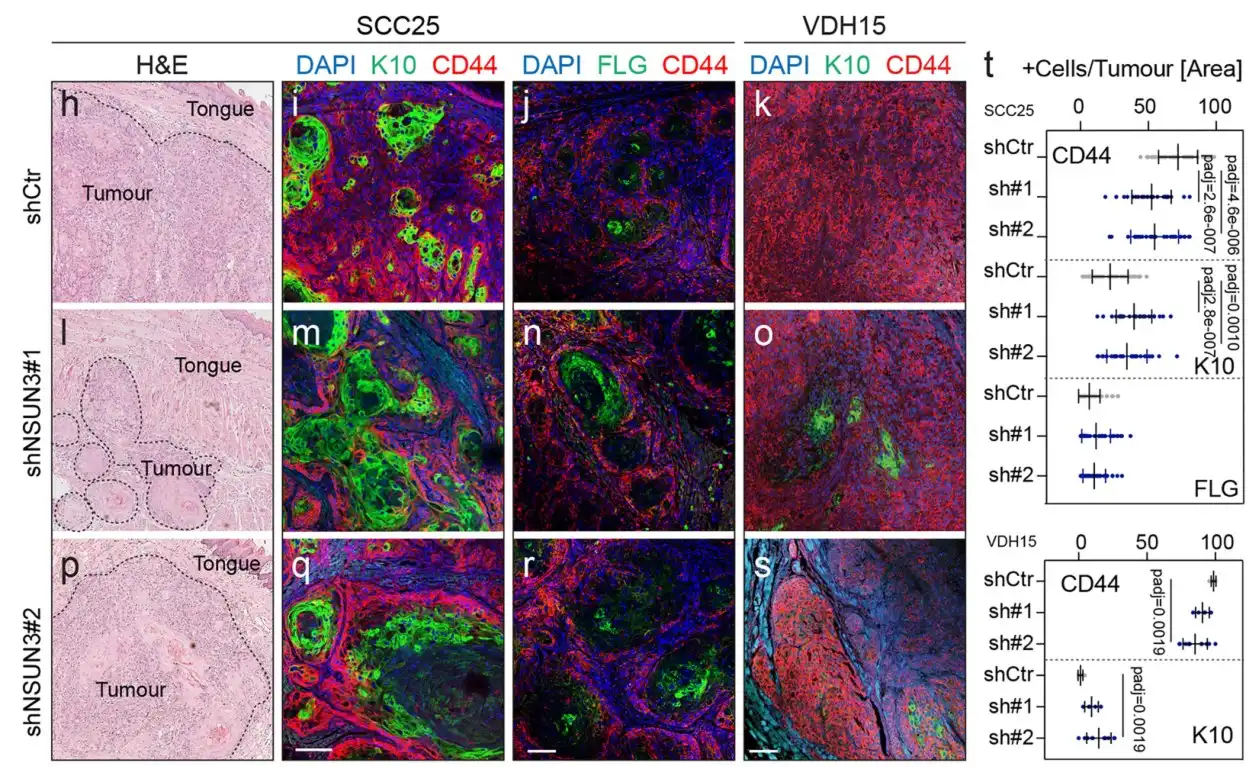
基于CD44/CD36表达量通过流式筛选出3类细胞,RT-qPCR在mRNA水平上验证CD44H CD36H细胞确实具有较高的CD36/CD44表达:
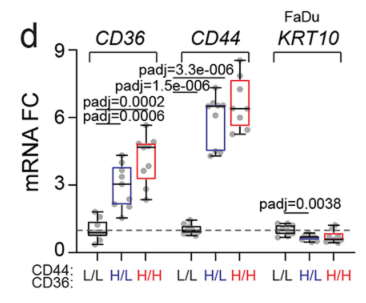
在CD44H细胞中,CMXROS实验表明CD44H细胞线粒体密度显著高于CD44L细胞,而在CD44H CD36H细胞中,NSUN3 RNA水平也较高。这些结果表明转移起始细胞的线粒体含量及NSUN3水平较高:
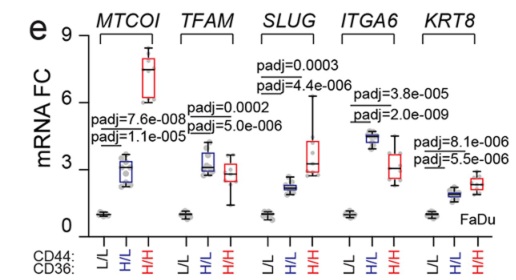
类似的结论可在细胞黏附蛋白(ITGA6)、转移相关蛋白(MMP、SLUG)、线粒体调节蛋白(MTCOI、TFAM)、KRT8的探索中得到证实:
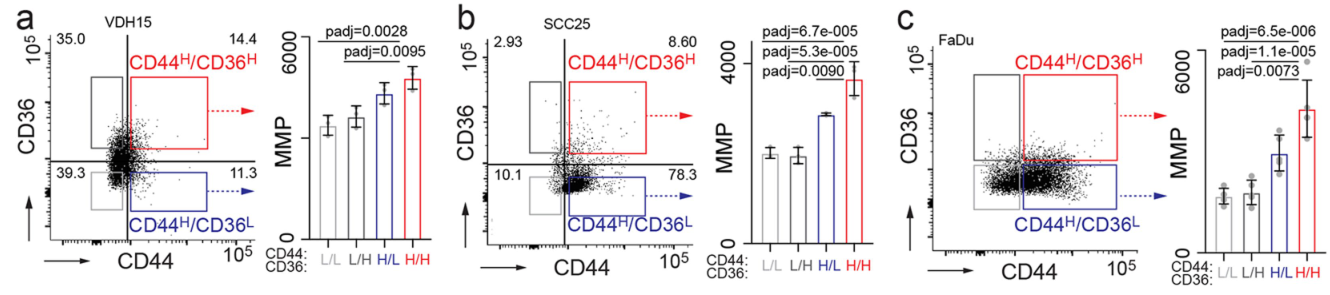
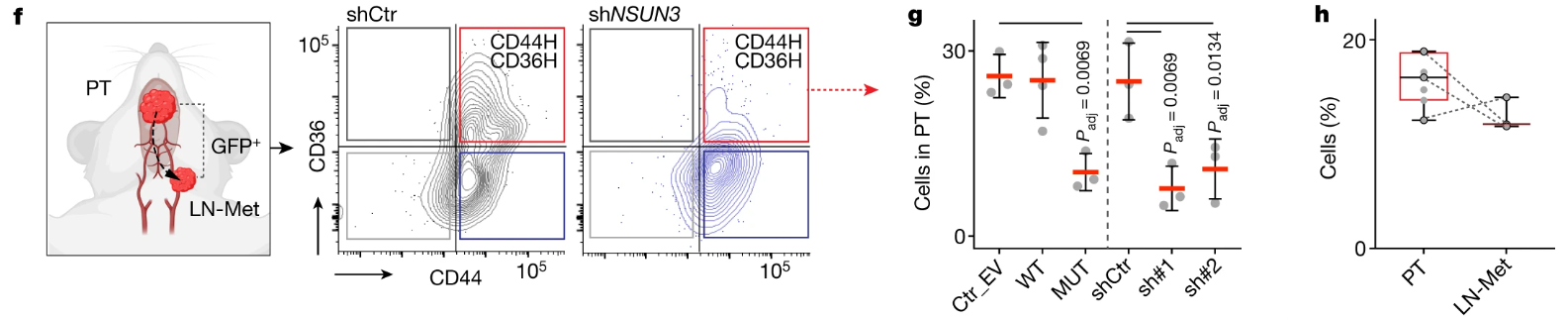
更进一步的,NSUN3抑制可导致原位肿瘤中CD44H CD36H细胞比例减小:
h图的作用是?
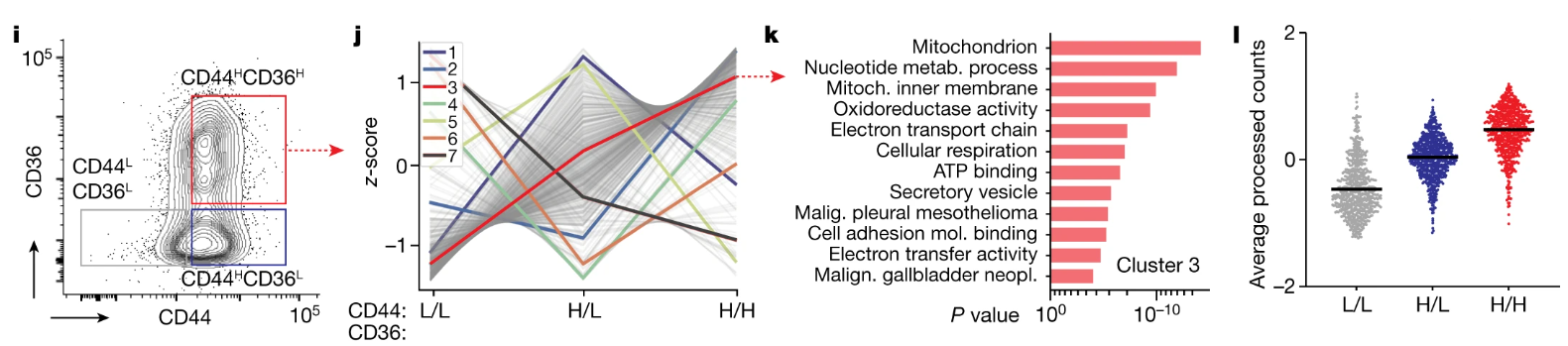
翻译组学分析筛选出在CD44L CD36L——CD44H CD36L——CD44H CD36H中表达量逐渐升高的基因亚群,通过GO富集分析表明这些基因主要富集在线粒体及呼吸作用相关通路:
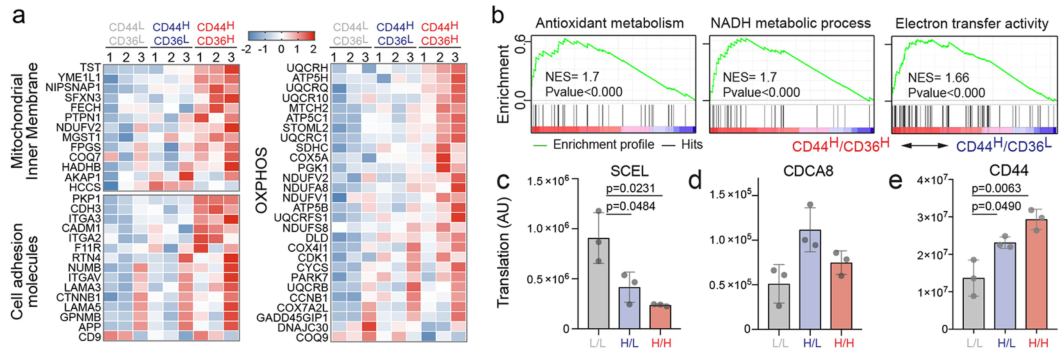
CD44H CD36H细胞的线粒体内膜蛋白、细胞黏附、氧化磷酸化的相关基因表达均高于CD44L CD36L或CD44H CD36L:
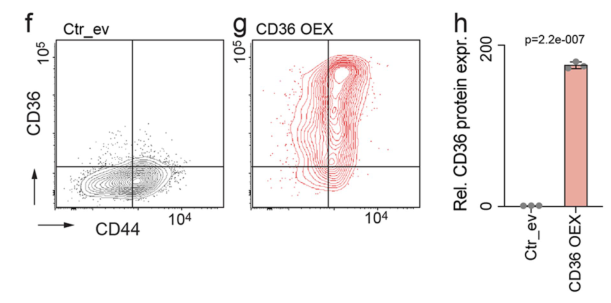
接下来,研究者们在NSUN3受抑制的情况下研究CD36回复的相应影响,以研究NSUN3-CD36的相互作用。首先,研究者们先确定CD3过表达细胞模型构建成功:
在NSUN3受抑制的情况下,CD36-OE可一定程度上回复NSUN3的RNA表达:
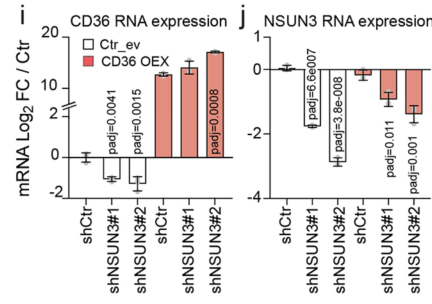
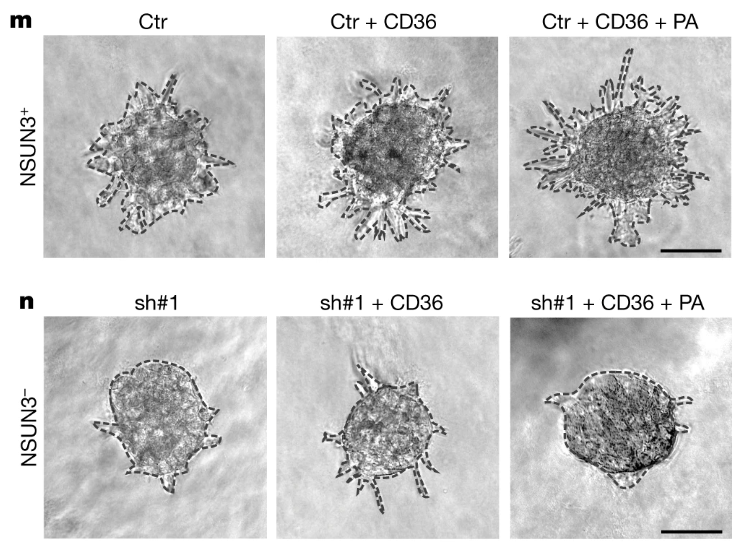
NSUN3受抑制时,尽管过表达CD36(加与不加棕榈酸),leader细胞的数量也没有明显升高,表明CD36介导的转移起始过程依赖NSUN3:
这里加/不加棕榈酸的实验设计暂时没看懂,它要控制的是什么混杂因素?TCA相关吗?
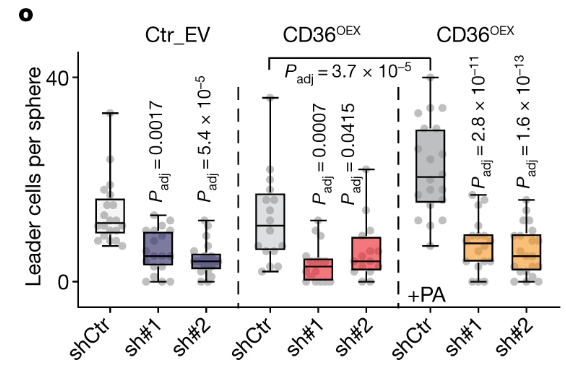
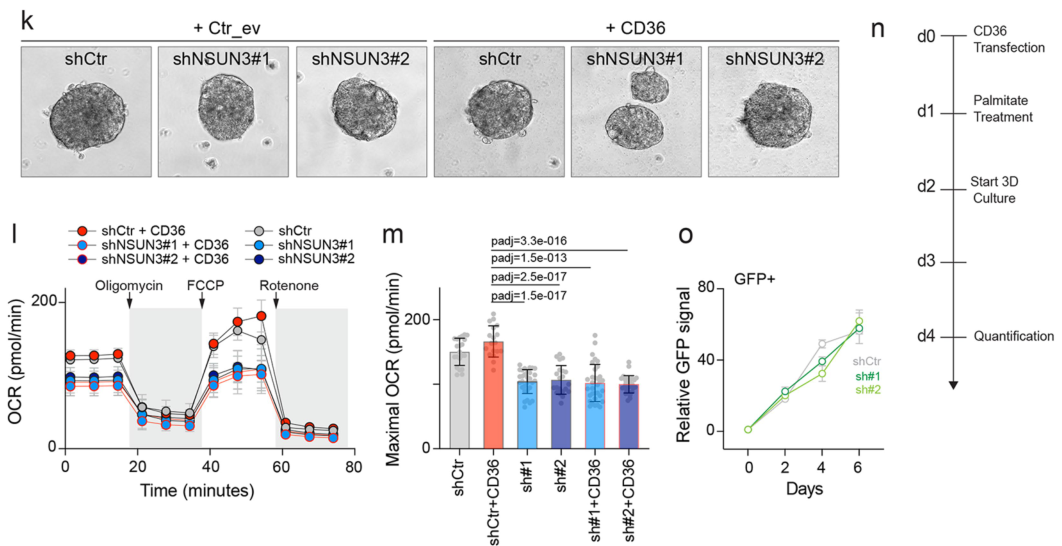
NSUN3受抑制的情况下,CD36-OE对类肿瘤大小、OCR均无明显影响,这进一步佐证了CD36介导的肿瘤细胞功能学变化依赖NSUN3:
NSUN3表达受抑制或失活后,原位肿瘤的CD44H CD36H细胞含量逐渐下降,而在活细胞(Ann–PI–)占比则无明显变化,NSUN3可促进CD44和CD36的表达,从而诱导转录起始过程,且不影响肿瘤细胞存活:
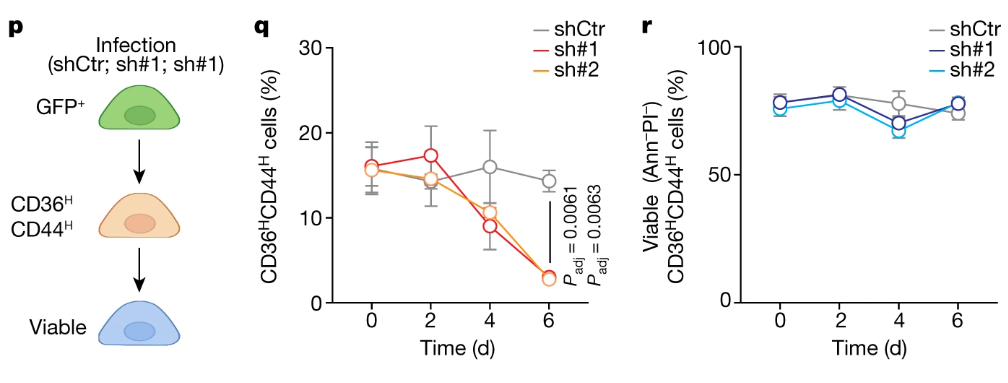
NSUN3驱动的基因特征可预测HNSCC患者的转移
NSUN3与临床特征的关系。这部分内容的框架属于常(tao)规(lu)操作。
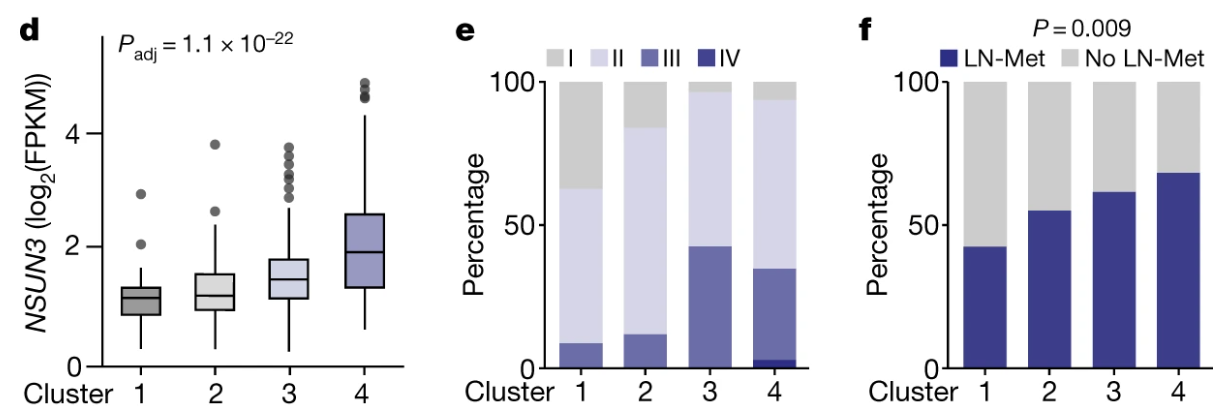
临床标本表明原位瘤NSUN3表达与淋巴转移分期呈正相关:
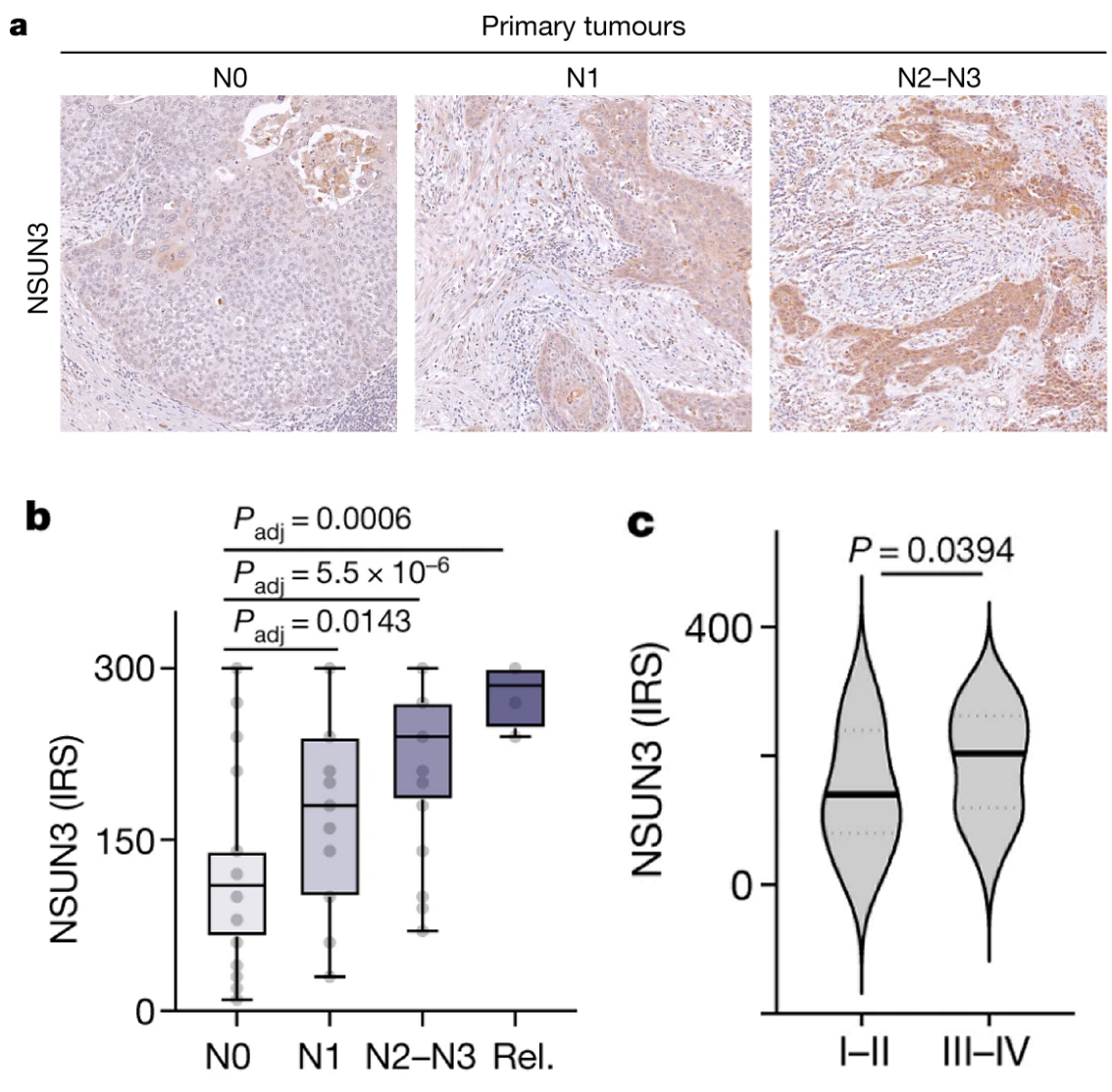
作者只是定性分析?
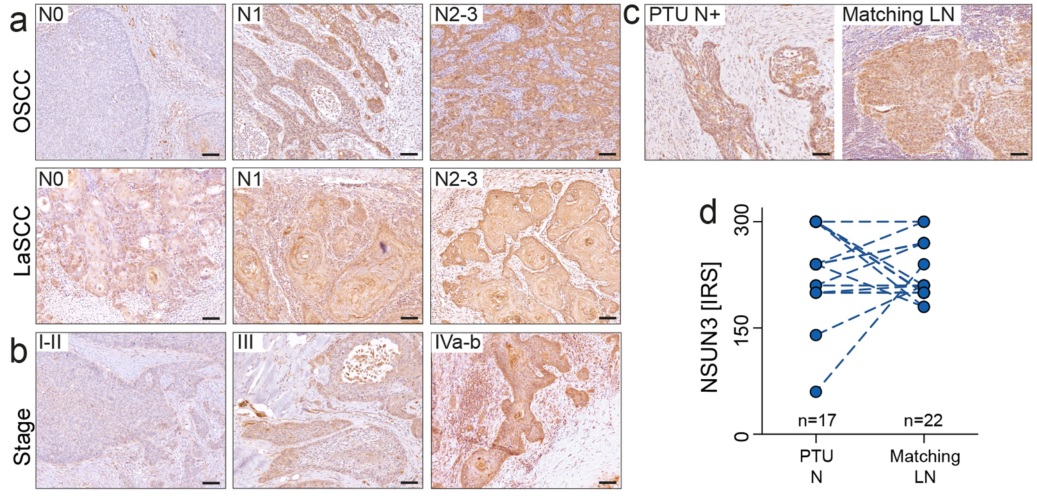
研究者们还根据NSUN3相关基因表达情况进行分类:
非常直接而简单的策略
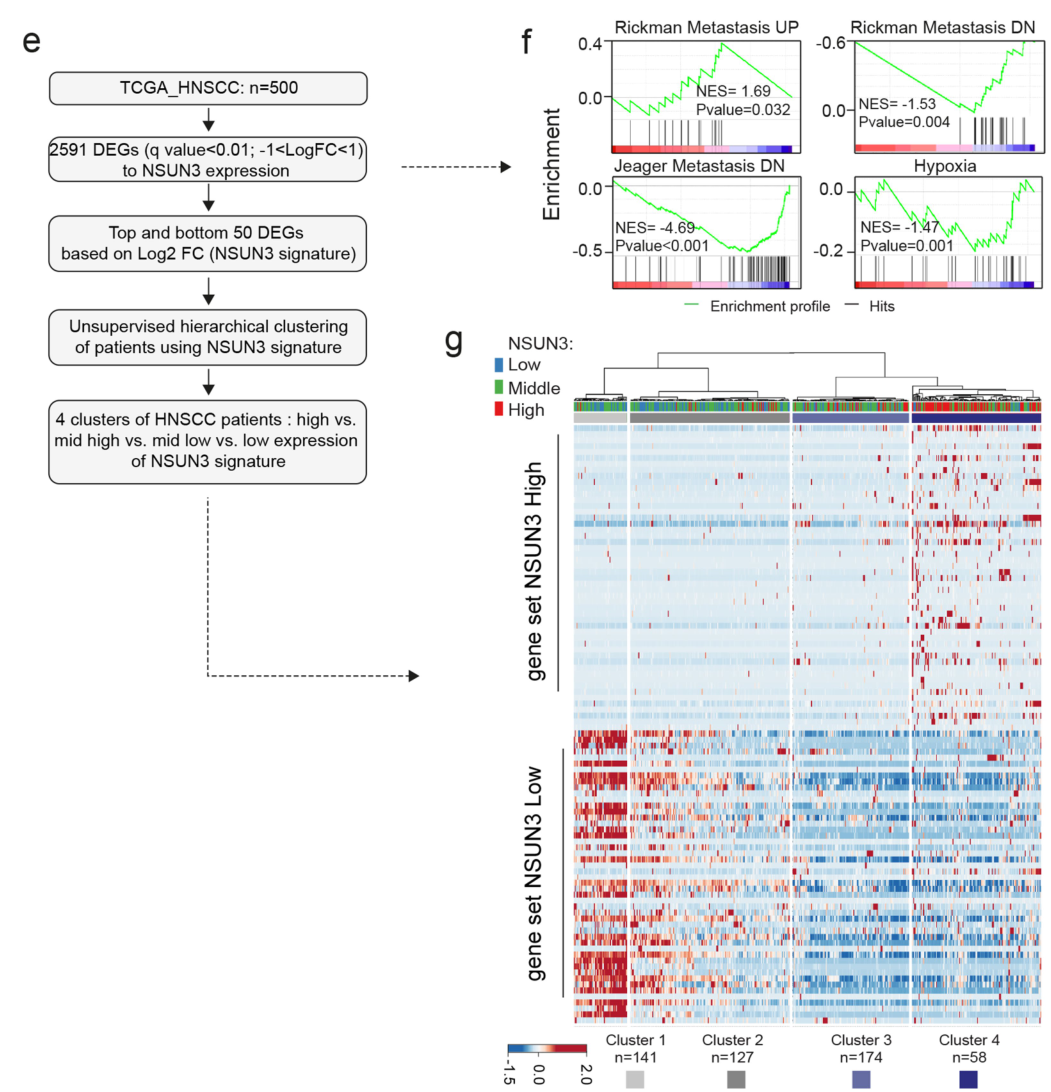
HNSCC (TGCA)的四分型NSUN3表达逐级上升?:
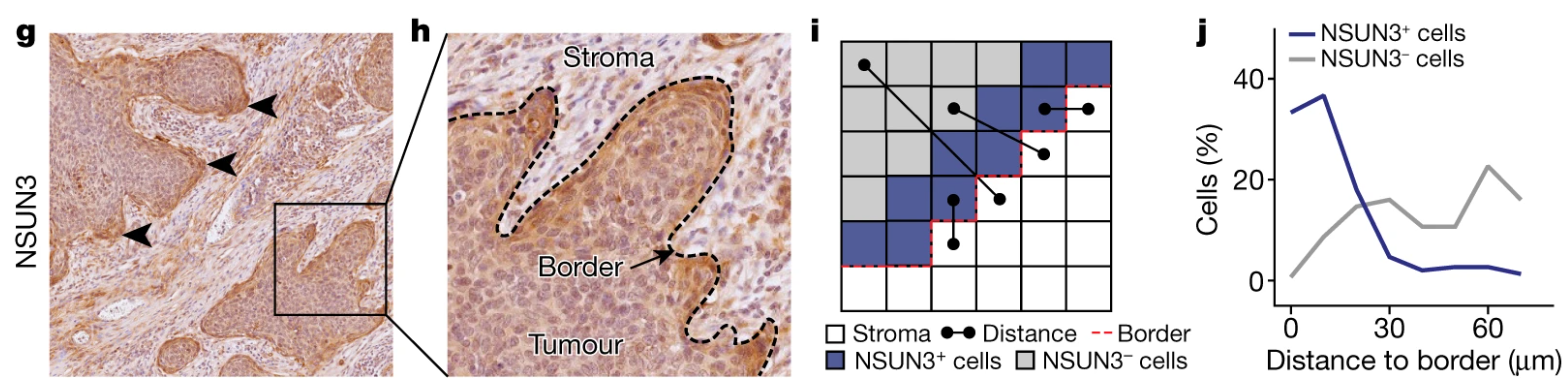
肿瘤侵袭边界越近的地方,NSUN3表达水平越高:
抑制线粒体翻译可防止转移
临床转化,老药新用。靶向线粒体翻译的药物可抑制肿瘤转移,常规操作。
由于线粒体和原核蛋白质合成机制高度相似,因此甘氨酰环素、恶唑烷酮和霉素等几类抗生素也可以靶向线粒体、核糖体。
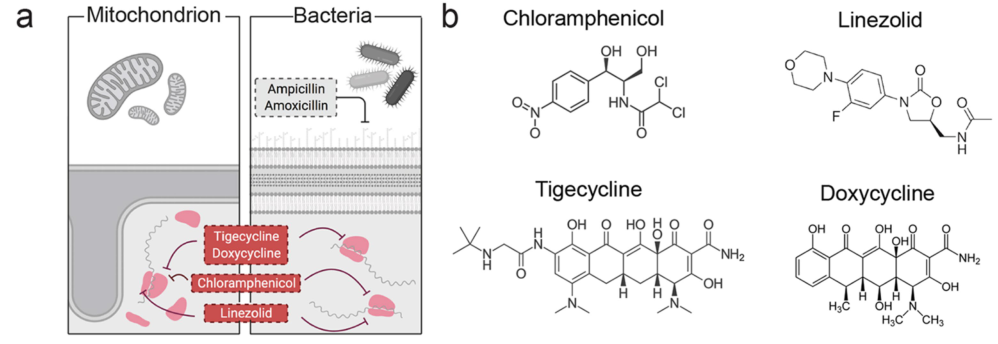
利奈唑胺 (LIN)、氯霉素 (CAP)、替加环素 (TIG) 或强力霉素 (DOX) 治疗癌细胞会抑制线粒体蛋白质合成,降低氧化磷酸化能力并增加细胞外酸化率。氨苄青霉素 (AMP) 和阿莫西林 (AMOX) 均靶向细菌细胞壁,线粒体翻译和功能不受这些抗生素的影响。
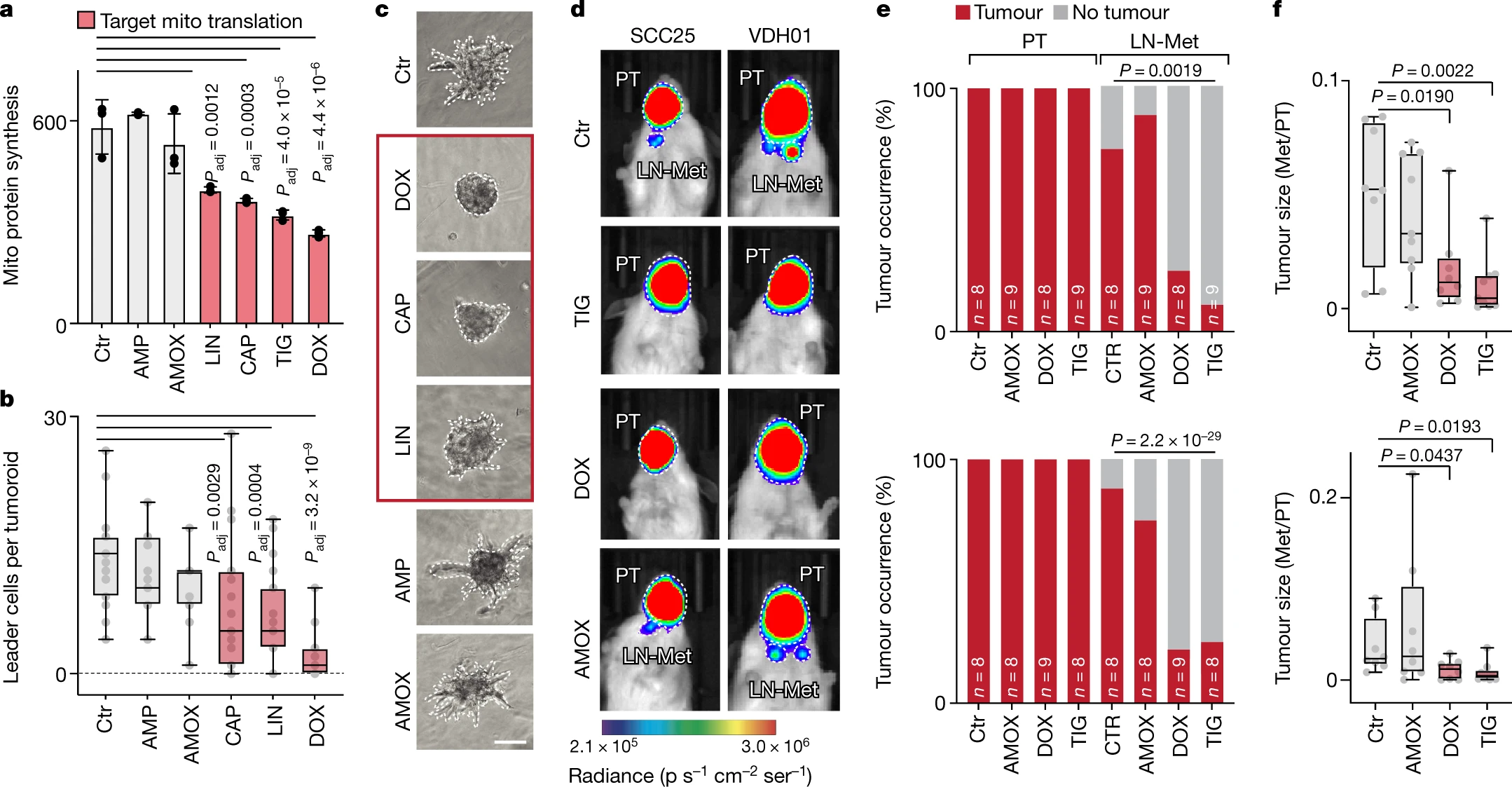
TIG等药物阻断线粒体翻译后可抑制肿瘤转移:
但TIC等线粒体翻译阻断剂对肿瘤生长没有影响:
小结
有其它观点希望可以评论区留言喔!
本研究的主要创新点在于明确线粒体tRNA的m5C和f5C修饰在肿瘤转移中的作用,并提出线粒体翻译可作为潜在的抗转移靶点。总体上看,其实本研究的创新点并不多,比如NSUN3调控m5C也是既往研究已经确认了的;研究方法基本上都是老一套;NSUN3下游通路改变的研究更是中规中矩。总之,整篇文章的实验论证比一般CNS论文稍差一档;但由于本研究较早关注线粒体RNA修饰对肿瘤的作用及相关机制,估计是开创性比新强,所以能在CNS上发表(或者是其它未知原因)。
整体上,很多实验的结论相互交织,在比较细的层面上,结构层次感稍差些;不过,研究者在论证肿瘤侵袭和转移的过程还是比较详尽的,与肿瘤转移相关的设计(转移起始细胞、leader细胞与侵袭伪足)也值得学习。在整体行文中,研究者还将控制NSUN3等同于控制m5C,个人觉得这种泛化的处理不太严谨。为什么不直接说是NSUN3?此外,虽然f5C是作者立论的重点之一,但作者似乎没有特别关注ALKBH1-f5C对转移的影响,只是简单地论证了一下NSUN3不影响ALKBH1的表达,这点稍有欠缺。
在临床上,比如胃癌或者食管癌,很多T分期较早的患者常常已经发生淋巴结转移;既往研究的很多观察也表明增殖性癌细胞到转移性癌细胞的转变要经历许多功能学重编程,比如EMT。代谢重编程在肿瘤转移中扮演重要角色,而本研究的结果则暗示肿瘤转移的代谢重编程可能是特异性的,与肿瘤细胞增殖相互独立。这对后续的肿瘤转移特异性改变、肿瘤转移易感性等领域的研究很有启发。靶点转化方面,个人感觉临床应用前景有限,毕竟抗肿瘤(原发+转移)会比抗转移的策略更具有普适性;但也许此研究的后续系列会有新的结果、新的靶点吧。
---------------
完结,撒花!如果您点一下广告,可以养活苯苯😍😍😍
