概览
- 本文围绕 甲基转移酶催化组蛋白调控基因转录的具体机制 展开详细讨论
- 包含 10 个主要章节内容
- 文末提供总结与展望
前言
此文内容目前处于BETA版本
SMYD5 catalyzes histone H3 lysine 36 trimethylation at promoters. Nat Commun. 2022
来自浙大Fang Dong团队,研究甲基转移酶催化组蛋白调控基因转录的具体机制。
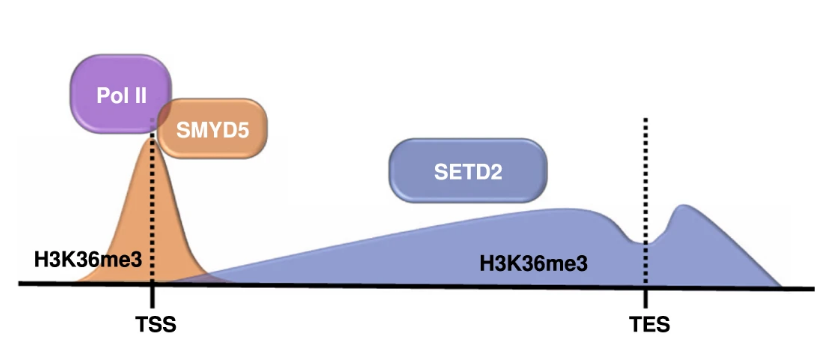
结果
H3K36me3富集于启动子区域
通过CUT&Tag技术发现H3K36me3富集于启动子区域,并且不依赖Setd2(Setd2被认为参与H3K36me3与gene body的结合)。
不太理解a图中的gene body信号差异(WT v.s. Setd2 KO)为什么没有后面两种方法明显。是因为CUT&Tag时的H3K36me3与靶基因body连接不够紧密?
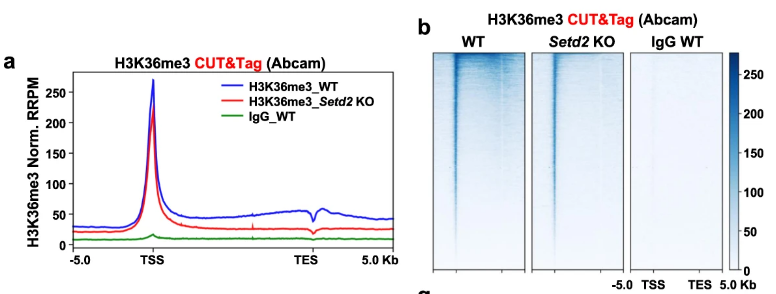
“H3K36me3富集于启动子区域”可能是假阳性现象,作者就以下混杂因素展开实验来论证:
- 抗体非特异性占位(2个抗体)
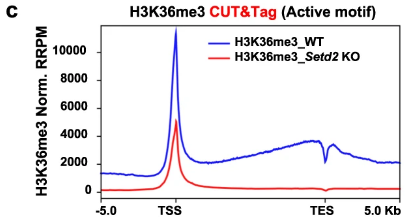
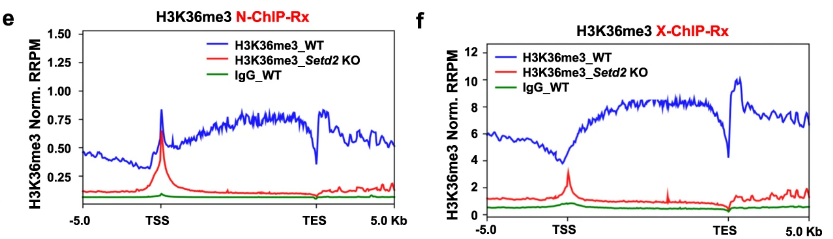
- 测量方法(CUT&Tag; N-Chip-Rx;X-Chip-Rx;前者是新方法,后两种是常规方法)
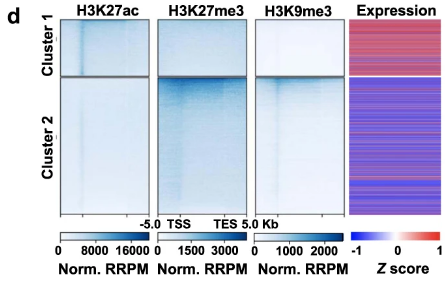
- Tn5转座体(Tn5 transposome)随机靶向开放性染色质区域:通过RNA-Seq + ATAC-seq的数据,发现H3K27me3和K3K9me3的高表达基因的启动子区域其实并没有非特异性富集,间接证明了这种猜想的存在性较弱或不可能。
- Pol II占位(使用Flavopiridol、THZ1或高盐将Pol II从染色质中移除);
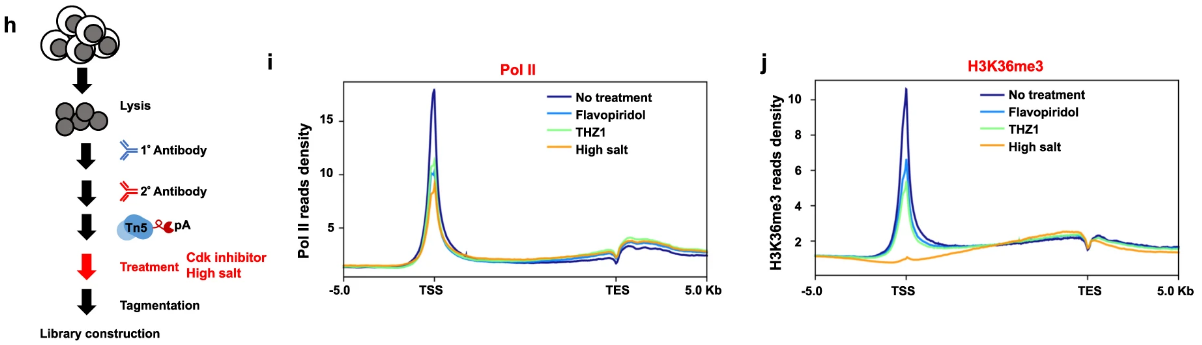
系列实验表明H3K36me3富集于启动子区域,且受Pol II的调控。
SMYD5促进H3K36me3甲基化从而诱导其在启动子区域募集
研究者用简单粗暴的方法进行筛选,即通过限定条件初步锁定30余个侯选甲基转移酶,分别KO之,然后测量它们对H3K36me3在启动子区域募集程度(Index)的改变:
图很简单,工作量却不小
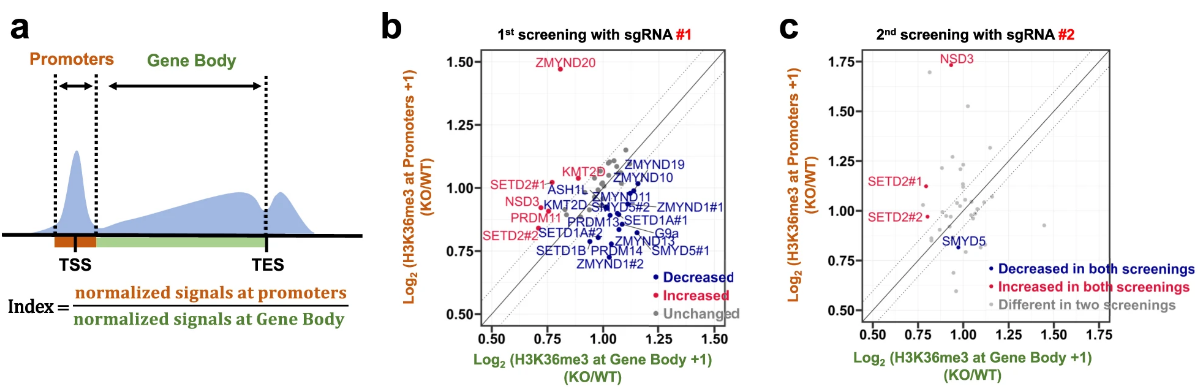
双sgRNA-ko细胞株共同确定了Smyd5这个甲基转移酶。研究者对Symd5影响H3K36me3启动子富集的结果进行了单独展示:
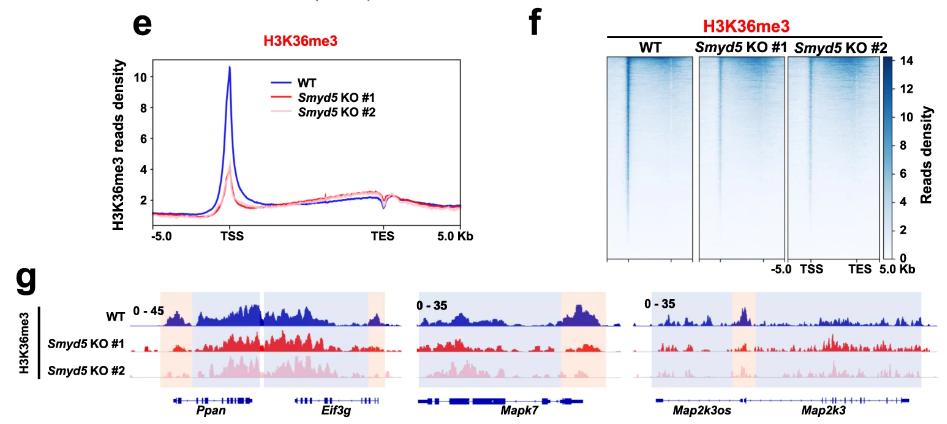
为了确定SMYD5甲基化H3形成H3K36me3,作者需要排除SMYD5是否影响H3K36me3的总表达水平。结果表明Smyd5不影响H3K36me3的总体表达:
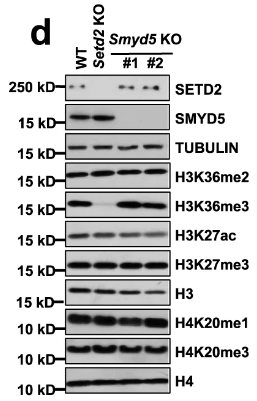
为了明确SMYD5甲基化H3K36的效应及具体位置(重组核心核小体 or 组蛋白八聚体),作者通过以下实验论证观点:
- histone methyltransferase assay(HMT实验)
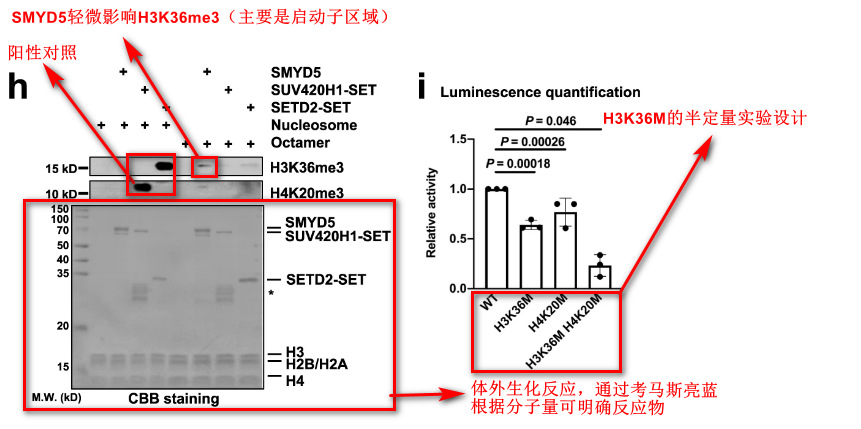
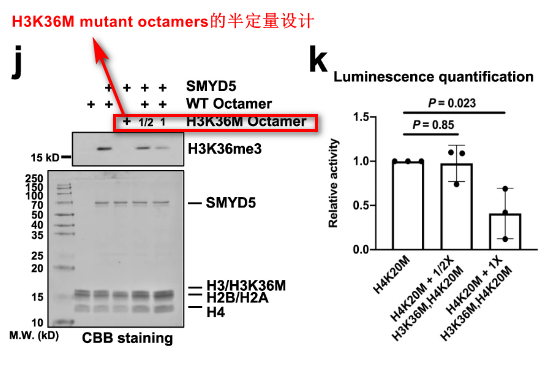
- HMT实验 + H3K36M mutant octamers。这里运用了半定量的实验设计。
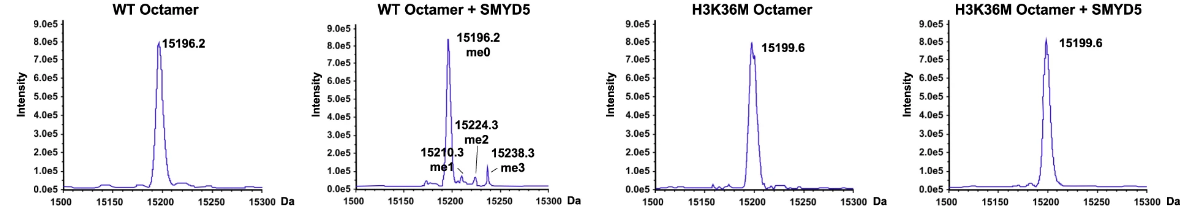
- ESI-TOF质谱分析检测3个甲基的信号:
SMYD5定位在启动子甲基化H3K36me3并调节基因表达
前面论证完H3K36me3在启动子的富集,所以还要看看SMYD5是否在可以在启动子区域富集。毕竟SMTD5要催化H3K36,物理位置应当具有一致性。
首先,排除FLAG标签对H3多种蛋白的影响(即不影响 H3K36me2的含量):
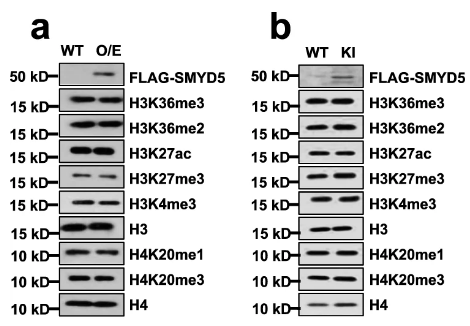
回复实验(WT vs. OE vs. KI)表明Smyd5可在启动子区域募集:
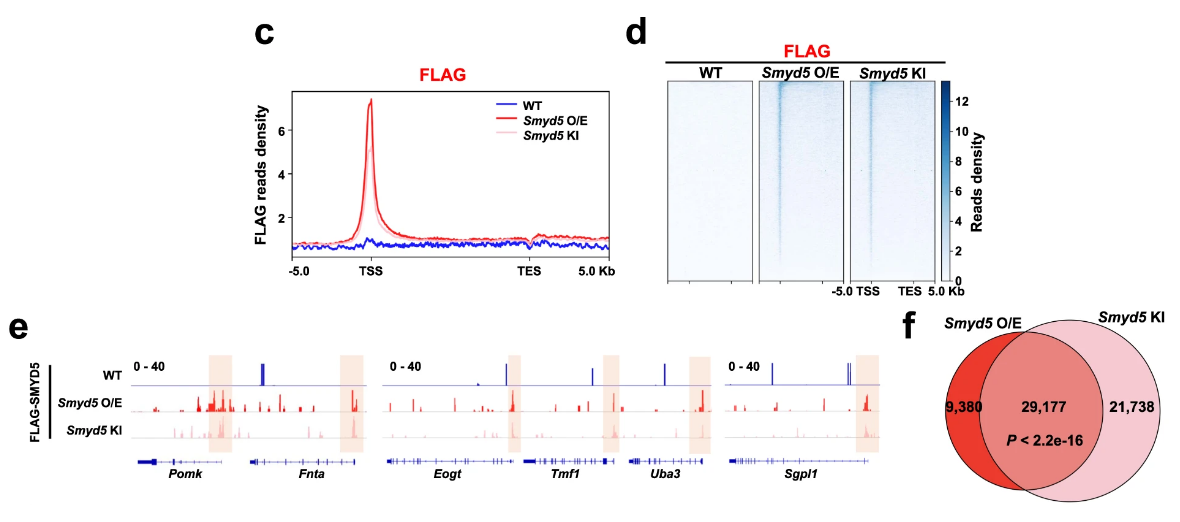
Smyd5在启动子区域募集的信号强度与H3K36me3在启动子区域募集的信号强度成正比(WT vs. OE/KI; KO vs. KO-OE/KI):
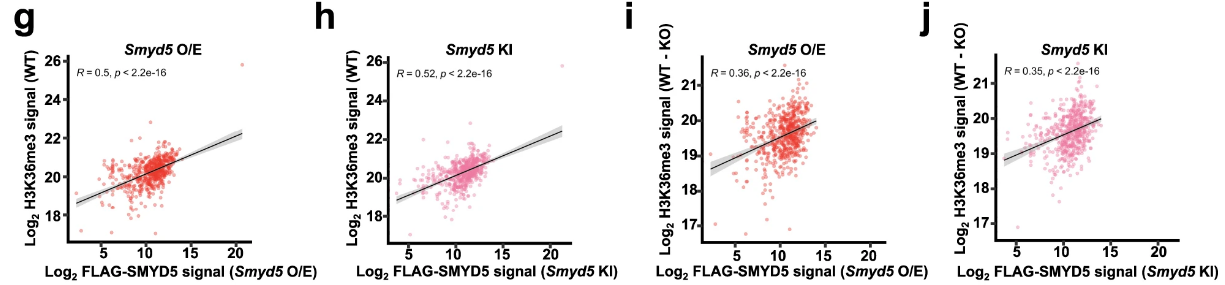
OE/KI的半定量实验:
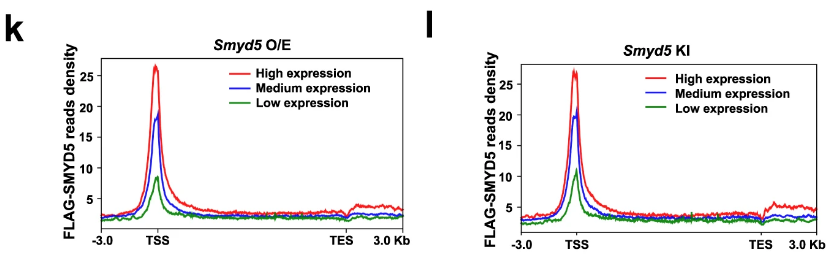
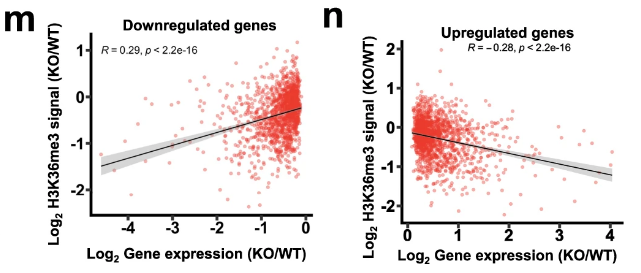
H3K36me3在启动子区域募集的信号强度与基因表达(Smyd5-KO/WT)下调程度成反比?
We observed a strong positive correlation (R = 0.29) between the changes in downregulated genes and H3K36me3 levels and a strong negative correlation (R = −0.28) between the alterations in upregulated genes and H3K36me3 levels. 这说明了什么?
Pol II与SMYD5互作并影响SMYD5催化H3K36me3的活性
前面讲完H3K36me3和SMYD5,要讲与Pol II的相互作用。机制更加深入。
co-IP互拉:拉Smyd5、FLAG-Smyd5或拉Pol II,证明Pol II与SMYD5互作。
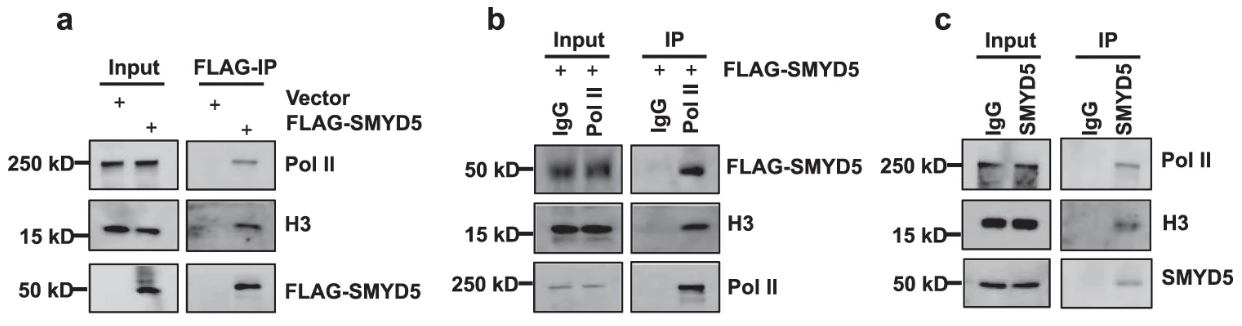
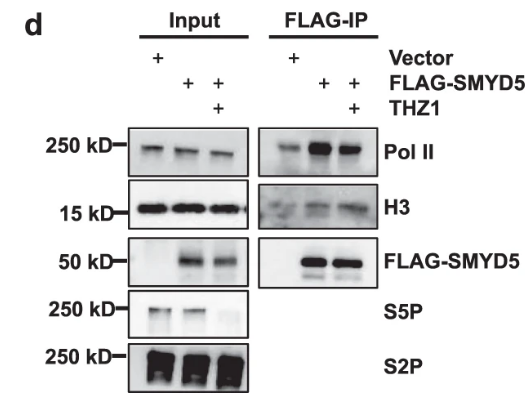
THZ1(CDK7 inhibitor,Remove Pol II from promoters)可影响Pol II与SMYD5的互作:
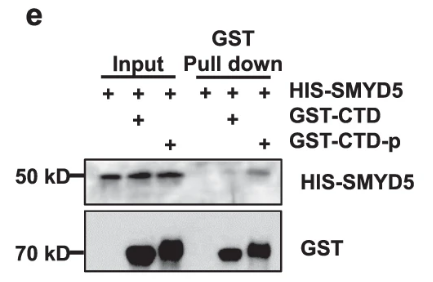
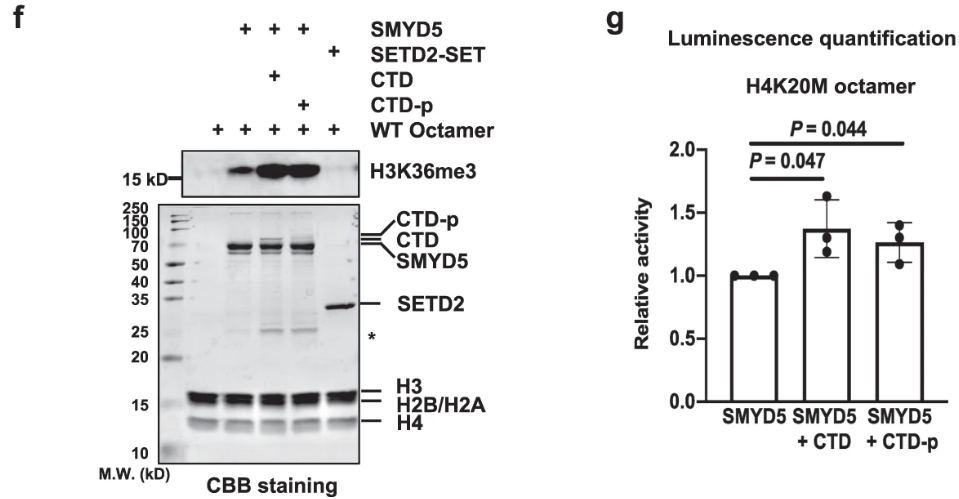
GST tagged Pol II CTD was purified and then phosphorylated by the CDK7-Cyclin H complex. 发现Smyd5只与CTD-p而不与CTD互作:
Pol II C-terminal domain (CTD),即Pol II C-末端结构域
通过HMT实验证明SMYD5甲基化H3K36me3的过程依赖CTD-p:
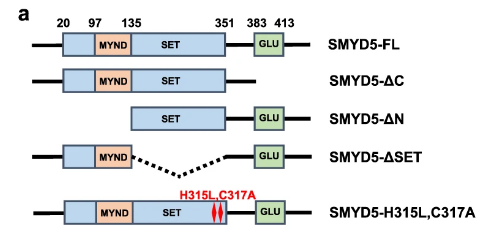
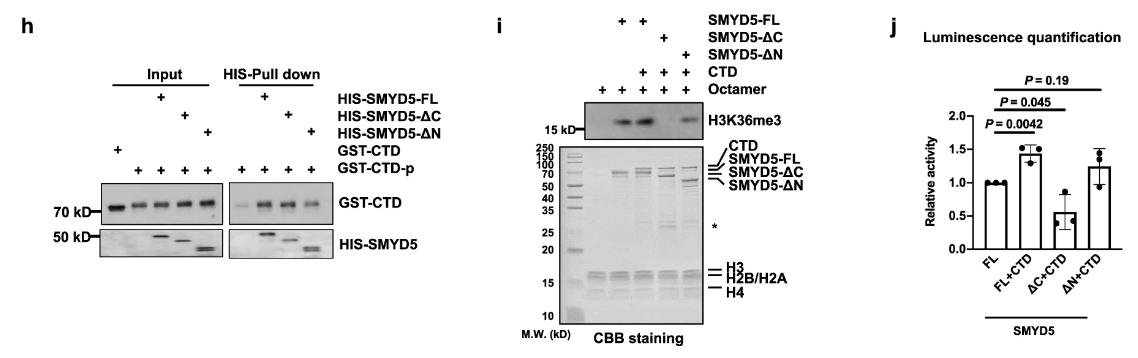
SMYD5的C端具有甲基转移酶活性
明确分子功能的有效结构域。分子医学研究者的常规操作。
研究者设计了不同的SMYD5片段进行实验:C-terminal domain-deleted SMYD5 (SMYD5-ΔC), and N-terminal domain-deleted SMYD5 (SMYD5-ΔN)
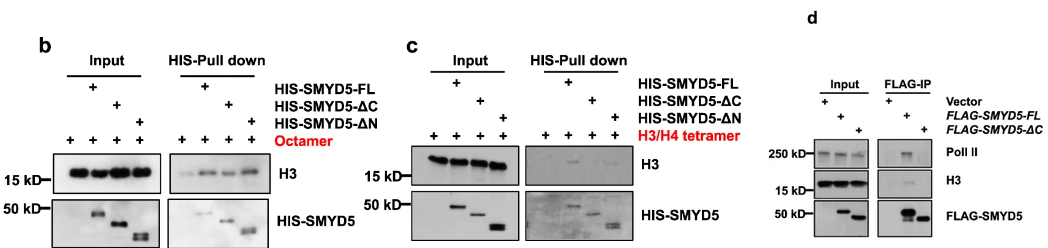
发现SMYD5失去C端后与H3成分的结合能力变弱:
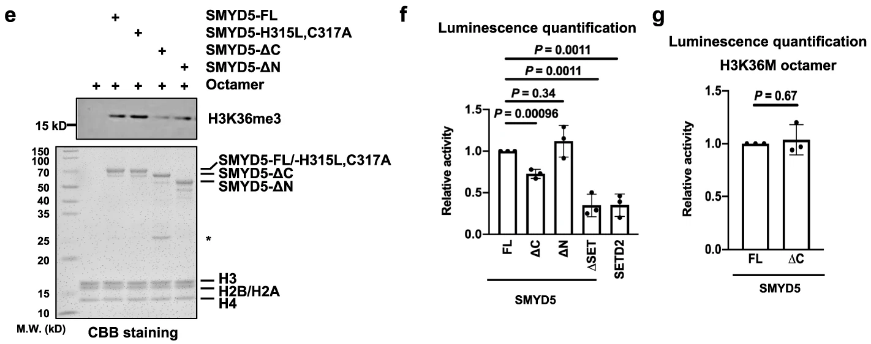
SMYD5失去C端后甲基转移酶活性也变弱:
SMYD5失去C端后,与CTD/CTD-p结合能力变弱,SMYD5的CTD依赖的甲基转移酶活性变弱:
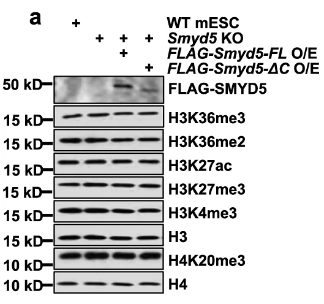
过表达Smyd5恢复H3K36me3和基因表达
回复实验。分子医学常规操作。
首先,排除过表达Smyd5对整体H3/H4水平没有影响:
Smyd5-full和Smyd5-ΔC均可与启动子区域相结合,也不影响H4组蛋白在启动子区域的结合:
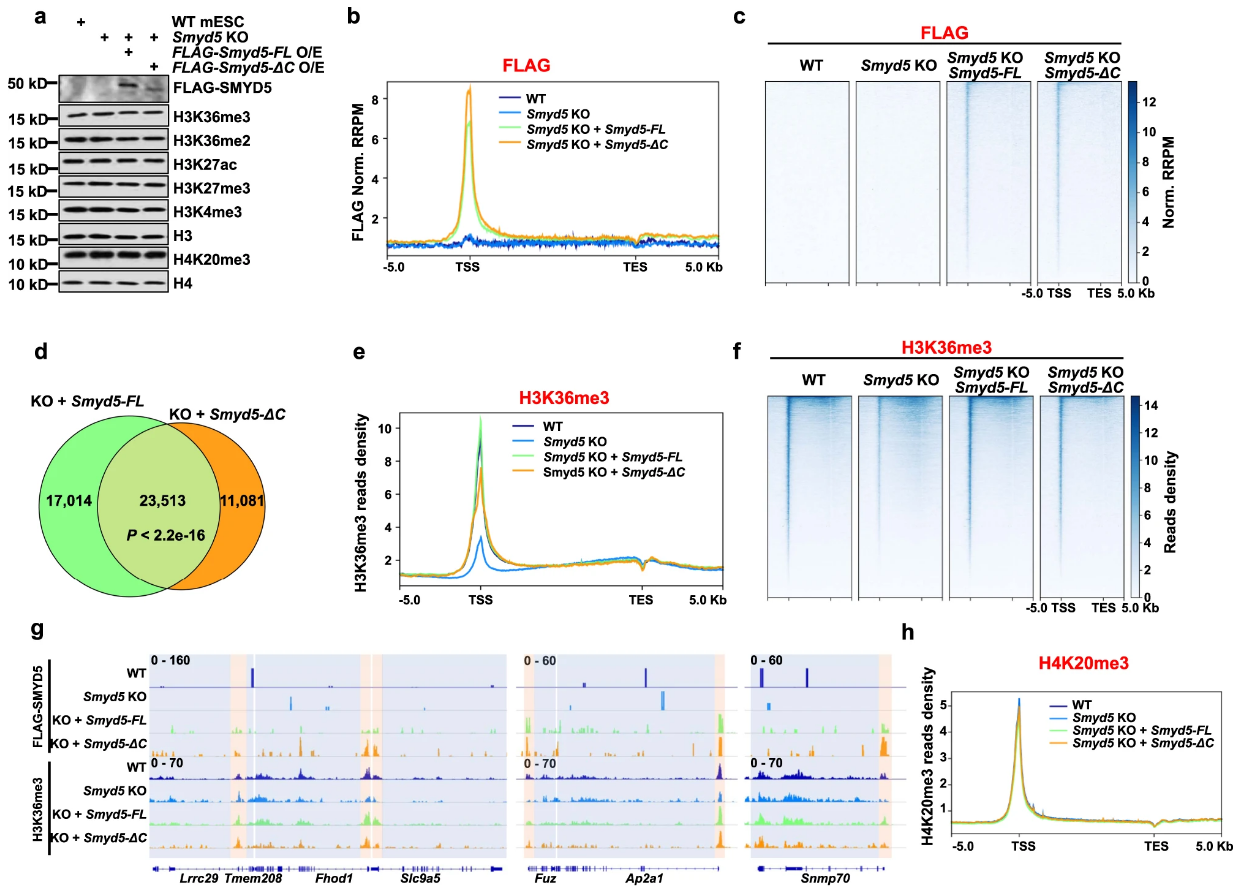
但Smyd5-ΔC(缺乏C端)时无法恢复基因表达:
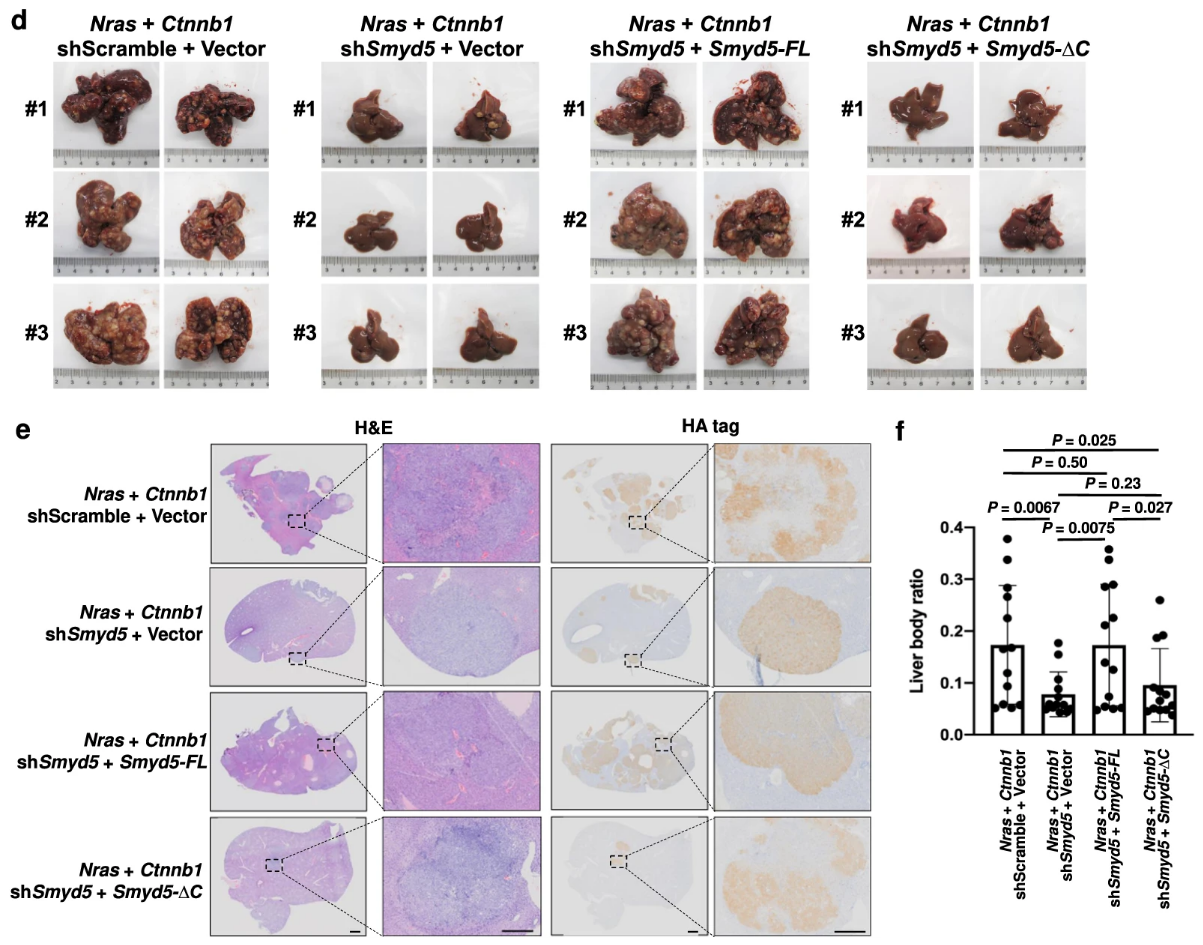
动物实验表明Smyd5具有促肝癌作用
基于前面的研究,这一节比较顺理成章。无特殊。
小结
研究者首先发现了一个现象:H3K36me3在基因启动子区域具有富集现象(既往认为H3K36me3只在基因体富集),这是本文的主要创新点。基于对研究对象和领域的深刻理解,研究者在前面的结果里大量运用了控制混杂因素的论证方法,让整个论证过程更加严谨和丰满。后面进一步挖掘H3K36me3在基因启动子区域富集的具体调控机制,发现了SMYD5这一关键调控因子。至于后续确定SMYD5调控H3K36me3的过程和具体部位,使用的都是该领域较经典的实验设计或方法。体内实验的设计与机制探讨的逻辑是相一致的,也比较常规。
---------------
完结,撒花!如果您点一下广告,可以养活苯苯😍😍😍
